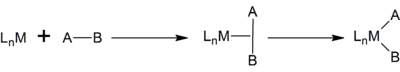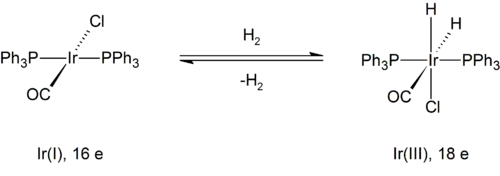Oxidační adice
Oxidační adice je organická reakce, při které se zvyšuje oxidační i koordinační číslo kovového centra. Je opačným procesem k redukční eliminaci. Často bývá součástí katalytických cyklů.[1]
Význam v chemii přechodných kovů
U přechodných kovů způsobuje oxidační adice snížení počtu elektronů v orbitalu dn, obvykle o dva elektrony. Oxidační adice dobře probíhají u prvků, jejichž atomy jsou zásadité a/nebo se dají snadno zoxidovat. Kovy s nízkými oxidačními čísly často splňují jeden z těchto požadavků; oxidační adice ovšem mohou probíhat i u vyšších oxidačních čísel.
Formální oxidační číslo kovu i počet elektronů v komplexu se obvykle zvýší o dva. Může také docházet ke změnám o jeden elektron, některé oxidační adice probíhají jako řetězce jednoelektronových reakcí. K oxidační adici může dojít při začlenění kovů do struktur řady různých substrátů, nejčastěji jde o H–H, H–X a C–X, protože takové sloučeniny mají největší využití.
K provedení oxidační adice je nutné, aby měl komplex volné koordinační místo. Proto tyto reakce nejčastěji probíhají u komplexů s koordinačními čísly 4 a 5.
Opačnou reakcí je redukční eliminace, ta probíhá přednostně, jestliže je případná vznikající vazba X-Y dostatečně silná. U redukční eliminace by dvě skupiny (označené X a Y) byly na sousedních pozicích vzhledem ke koordinační sféře. Redukční eliminace je u mnoha reakcí vytvářejících vazby C–H a C–C krokem, při kterém vzniká výsledný produkt.[1]
Mechanismus
Oxidační adice může v závislosti na vlastnostech kovového centra a substrátu probíhat několika různými mechanismy.
Soustředěný mechanismus
Oxidační adice nepolárních substrátů, jako jsou vodík a uhlovodíky, probíhají soustředěným mechanismem. Takovéto substráty nemají vazby π, v důsledku čehož vzniká sigma komplex. Poté dojde k zániku koordinační vazby u ligandu přenosem elektronů do σ* orbitalů této vazby za tvorby oxidovaného komplexu, Výsledné ligandy jsou vzájemně v poloze cis, může se však objevit izomerizace.[2]
Tento mechanismus se uplatňuje při adicích homonukleárních dvouatomových molekul jako je H2. Mnoho C–H aktivačních reakcí má také soustředěný mechanismus při tvorbě agostického komplexu (M–(C–H)).[2]
Příkladem je reakce vodíku s Vaskovým komplexem (trans-IrCl(CO)[P(C6H5)3]2). Oxidační číslo iridia se zde mění z +1 na +3. Produkt je navázán na tři anionty: jeden chloridový a dva hydridové ligandy. Původní komplex měl 16 elektronů a koordinační číslo 4, zatímco produkt má 18 elektronů a koordinační číslo 6.
Po tvorbě trigonálně bipyramidového meziproduktu následuje v důsledku dodání elektronů do orbitalu σ* vazby H–H její rozštěpení. Současně s oxidační adicí zde také probíhá redukční eliminace jejího produktu.[3]
Díky dodávání elektronů do orbitalu σ* vazby H–H tato reakce převažuje u kovů s vysokou elektronovou hustotou.[3] Soustředěným mechanismem vzniká cis dihydrid, u jiných mechanismů oxidační adice se většinou cis produkty netvoří.
SN2 mechanismus
Některé oxidační adice probíhají podobně jako bimolekulární nukleofilní substituce. Kovové centrum je atakováno elektropozitivnějším atomem substrátu, čímž zaniká vazba R–X a tvoří se meziprodukt se vzorcem [M–R]+. Následně dojde ke koordinaci aniontu na kation kovu. Příkladem může být reakce čtvercového rovinného komplexu s jodmethanem:
Tento mechanismus se objevuje u polárních a elektrofilních substrátů, jako jsou alkylhalogenidy a halogeny.[2]
Iontový mechanismus
Iontový mechanismus oxidační adice je podobný SN2 mechanismu, jelikož při něm postupně dochází k adici dvou různých částí ligandu. Rozdíl spočívá v tom, že u iontového mechanismu dochází k disociaci substrátu ještě před jakýmikoliv interakcemi s kovovým centrem. Takto probíhá například adice kyseliny chlorovodíkové.[2]
Radikálový mechanismus
Kromě SN2 mechanismu se mohou alkylhalogenidy a podobné sloučeniny adovat na kovová centra radikálově.[2] Předpokládá se, že takové reakce probíhají u Pt0-RX, Pt0-C6H5Br a PtII-R′SO2X (R = alkyl, R′ = aryl, X = halogenid).[4]
- Iniciace
- [(CH3)2C(CN)N]2 → 2 (CH3)2(CN)C• + N2
- (CH3)2(CN)C• + C6H5Br → (CH3)2(CN)CBr + Ph•
- Propagace
- C6H5• + {Pt[P(C6H5)3]2} → {Pt[P(C6H5)3]2C6H5}•
- {Pt[P(C6H5)3]2C6H5}• + C6H5Br → {Pt[P(C6H5)3]2C6H5Br} + C6H5•
Použití
Oxidační adice a redukční eliminace jsou součástí mnoha procesů při homogenní (například hydrogenace alkenů s použitím Wilkinsonova katalyzátoru) i heterogenní katalýze (jako je hydrogenace za přítomnosti platiny). Oxidační adice jsou také nutné k tomu, aby bylo možné provést nukleofilní adici na alkylové skupiny. Je také významnou součástí procesů jako jsou Suzukiho reakce, Negišiho reakce a Sonogašiho reakce.
Reference
V tomto článku byl použit překlad textu z článku Oxidative addition na anglické Wikipedii.
- J. F. Hartwig. Organotransition Metal Chemistry, from Bonding to Catalysis. [s.l.]: University Science Books, 2010. ISBN 1-891389-53-X.
- Robert Crabtree. The Organometallic Chemistry of the Transition Metals. [s.l.]: Wiley-Interscience, 2005. Dostupné online. ISBN 0-471-66256-9. S. 159–180.
- Curtis Johnson; Richard Eisenberg. Stereoselective Oxidative Addition of Hydrogen to Iridium(I) Complexes. Kinetic Control Based on Ligand Electronic Effects. Journal of the American Chemical Society. 1985, s. 3148–3160. DOI 10.1021/ja00297a021.
- Thomas L. Hall; Michael F. Lappert; Peter W. Lednor. Mechanistic studies of some oxidative-addition reactions: free-radical pathways in the Pt0-RX, Pt0-PhBr, and PtII-R′SO2X Reactions (R = alkyl, R′ = aryl, X = halide) and in the related rhodium(I) or iridium(I) Systems. Journal of the Chemical Society, Dalton Transactions. 1980, s. 1448–1456. DOI 10.1039/DT9800001448.