Hemoglobín
Hemoglobín (skratka Hb) je červené krvné farbivo. Tvorí najdôležitejšiu zložku erytrocytov (červených krviniek), v ktorých zaujíma približne 35 % objemu. Ide o hemoproteín, ktorý je schopný reverzibilne viazať molekulárny kyslík za vzniku oxyhemoglobínu a oxid uhličitý za vzniku karbaminohemoglobínu. Jeho hlavnou funkciou v organizme je transport týchto molekúl krvou z pľúc do orgánov a opačne.

Hemoglobín je zároveň jednou z najštudovanejších bielkovín v 20. storočí a jeho štúdium prinieslo niekoľko teoretických a praktických poznatkov, ktoré sú dodnes využívané všeobecne. Ide hlavne o všeobecné poznatky o bielkovinách, ktoré boli v dobe objavu štruktúry hemoglobínu veľmi obmedzené, a modely alosterickej modulácie navrhnuté na základe väzbovej krivky kyslíku na hemoglobín, ktoré sú dnes využívané v enzýmovej kinetike.[1]
Štruktúra

Štruktúra hemoglobínu bola zistená metódou röntgenovej kryštalografie v roku 1959 Maxom Perutzom (Nobelova cena v roku 1962), čím sa hemoglobín stal jednou z prvých bielkovín so známou trojrozmernou štruktúrou. Hemoglobín je globulárny hemoproteín, ktorého bielkovinová časť tvorí 96 % hmotnosti a jeho prostetickou skupinou je hem b. Na každú podjednotku hemoglobínu pripadá jeden hem b umiestnený približne v strede podjednotky. Bielkovinová časť je tvorená tetramérom - dvoma kratšími α podjednotkami (globínmi) (α1 a α2, 141 aminokyselín) a dvoma dlhšími β podjednotkami (β1 a β2, 146 aminokyselín). Pri aproximácii molekuly na guľový tvar má priemer 5,5 nm, v skutočnosti sa však hemoglobín podobá na štvorsten s jednotlivými podjednotkami umiestnenými v jeho vrcholoch.[1]
Každá podjednotka hemoglobínu má prevážne α-helikálnu štruktúru, ktorú dopĺňajú krátke ohyby a slučky. Jednotlivé hélixy sa označujú abecedne od N-konca (A - H), slučky a ohyby medzi nimi sú označované dvoma písmenami, ktoré odpovedajú susedným hélixom (AB-GH). Najdôležitejšou aminokyselinou je tzv. proximálny histidín na pozícii F8, ktorého dusík tvorí koordinačnú väzbu s atómom železa na heme v axiálnej pozícii. Proximálny histidín tiež spôsobuje, že železo sa nenachádza presne v rovine zvyšných atómov hemu, ale je z tejto roviny vychýlené o 0,4 Å. Väzbové miesto pre kyslík sa nachádza na axiálnej pozícii hemového železa z druhej strany hemu. Schopnosť viazať kyslík alebo iné ligandy je významne modulovaná ďalším tzv. distálnym histidínom v pozícii E7.[1][2]
V rámci evolúcie došlo na molekule hemoglobínu k mnohým mutáciám, no aminokyseliny na niektorých pozíciách sú identické na hemoglobínoch všetkých živočíchov. Ide o tzv. invariantné aminokyseliny - proximálny histidín dôležitý pre koordináciu hemu s bielkovinovou časťou, distálny histidín modulujúci afinitu hemoglobínu k substrátom, a ďalšie aminokyseliny, ktorých význam nie je zo štruktúry hemoglobínu natoľko zjavný.[2]
Vývinové formy

Počas vývinu predovšetkým v prenatálnom štádiu syntetizuje organizmus rôzne druhy podjednotiek hemoglobínu. Tieto podjednotky sú označované gréckymi písmenami, prvé písmeno označuje podjednotku, ktorá nahradzuje bežnú α podjednotku, a druhé písmeno označuje podjednotku, ktorá nahradzuje bežnú β podjednotku. Dolné indexy za podjednotkami označujú počet týchto podjednotiek (2). Jednotlivé kombinácie podjednotiek, čiže jednotlivé hemoglobíny, sú nazývané podľa miest, v ktorých boli objavené. Chronologicky v rámci vývinu ide o:
- Hemoglobín Gower 1: ζ2ε2
- Hemoglobín Gower 2: α2ε2
- Hemoglobín Portland 1: ζ2γ2
- Hemoglobín Portland 2: α2γ2
- Hemoglobín A: α2β2
- Hemoglobín A2: α2δ2
Hemoglobín A (skratka HbA) je odvodený od latinského adultus, čiže dospelý, Hemoglobín Portland 2 sa tiež označuje ako hemoglobín F (HbF), odvodené z latinského fetus, čiže plod. Prenatálne formy hemoglobínu sa vyznačujú vyššou afinitou ku kyslíku, čím je umožnený jeho ľahší prechod cez placentárnu bariéru z matky na plod. Hemoglobín A2 je syntetizovaný v dospelosti a v krvi človeka tvorí 1-2 %.[2]
Genetika
Gény pre podjednotky hemoglobínu sú u človeka komplexne usporiadané. Gény pre α a ζ podjednotky sú na chromozóme 16, ostatné podjednotky na chromozóme 11. Každý 16. chomozóm nesie dva gény pre α-podjednotku. Ako je typické pre eukaryotickú DNA, sú usporiadané za sebou, v tzv. klastroch. V DNA eukaryotických organizmov sa nachádzajú tiež pseudogény pre hemoglobíny, čo sú sekvencie DNA podobné funkčným génom pre podjednotky hemoglobínu, ktoré však nie sú prepisované na mRNA. Z génovej štruktúry hemoglobínu je zjavné, že jednotlivé kópie vznikli duplikáciou. Všetky gény pre podjednotky hemoglobínu a podobných bielkovín majú rovnaké usporiadanie exónov a intrónov.
Väzba kyslíka
Jedna molekula hemoglobínu je schopná viazať štyri biatomárne molekuly kyslíku. Kyslík tvorí koordinačnú väzbu na axiálnej pozícii hemového železa, z druhej strany proximálneho histidínu. Sila väzby kyslíku spôsobuje, že hemové železo sa vráti do roviny porfyrínového kruhu. Väzba kyslíka je významne ovplyvnená distálnym histidínom, vďaka ktorému je vzdialenejší atóm kyslíku odchýlený od osi kolmej na porfyrín. Vďaka tomuto efektu je väzba kyslíka mierne oslabená a nedochádza tak ku oxidácii železa do oxidačného stavu III. Distálny histidín tiež výrazne znižuje relatívnu afinitu jedovatého oxidu uhoľnatého.
Afinita kyslíku k molekule hemoglobínu je významne regulovaná ako koordináciou podjednotiek hemoglobínu, tak aj väzbou iných molekúl na odlišné väzbové miesta hemoglobínu. Afinitu tiež ovplyvňuje pH.[3]
Koordinácia

Štúdium koordinácie podjednotiek hemoglobínu pri väzbe kyslíku viedlo k dvom modelom (sekvenčný a symetrický model), ktoré sa uplatňujú všeobecne pre podobné prípady koordinácie. Základom oboch modelov je fakt, že hemoglobín môže existovať v dvoch stavoch. Hemoglobín v nízkoafinitnom stave (T stav, z angl. tensed, napätý) má nízku afinitu ku kyslíku a žiadny kyslík ani naviazaný nemá. Naopak, vo vysokoafinitnom stave (R stav, z angl. relaxed, voľný) má hemoglobín vysokú afinitu ku kyslíku a je tiež naviazaný na danej podjednotke. Podľa sekvenčného modelu môže byť každá podjednotka nezávisle od seba buď v T alebo R stave, pričom každá podjednotka v R stave "núti" ostatné podjednotky, aby sa tiež dostali do R stavu. Podľa symetrického modelu sú vždy všetky jednotky buď v T stave, alebo sú všetky jednotky v R stave. Zatiaľ čo sekvenčný model sa viac podobá reálnym procesom potvrdeným na základe trojdimenzionálnych štruktúr jednodlivých stavov hemoglobínu, oba modely sú matematicky porovnateľne správne pre výpočet väzbovej afinity.
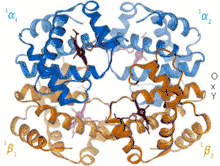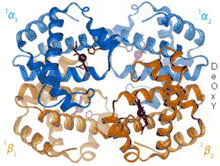
Z oboch modelov, ktoré sú založené na pozorovaní krivky väzbovej afinity, vyplýva, že krivka väzbovej afinity (závislosť afinity hemoglobínu ku kyslíku na jeho parciálnom tlaku) nie je hyperbola (čo je typické pre systémy bez koordinácie), ale sigmoida. Vďaka tomu má hemoglobín potrebné vlastnosti pre rýchle naviazanie kyslíka pri jeho vysokom parciálnom tlaku (napr. v pľúcach) a rýchle odovzdanie kyslíka pri jeho nízkom parciálnom tlaku (napr. v svaloch, kde je vychytávaný myoglobínom).
Zo štruktúrneho hľadiska je efekt koordinácie spôsobený zmenou konformácie podjednotky, na ktorú sa viaže kyslík. Kyslík po naviazaní do axiálnej pozície hemového železa spôsobí, že sa toto železo dostane z pozície pod rovinou porfyrínového kruhu do jeho roviny a tým prostredníctvom proximálneho histidínu posúva pozíciu celého α-hélixu F. Táto konformačná zmena spôsobuje ďalšie konformačné zmeny v ostatných podjednotách hemoglobínu, ktoré tak získavajú vyššiu afinitu ku kyslíku.
2,3-bisfosfoglycerát
2,3-bisfosfoglycerát je intermediátom glykolýzy a v krvi sa teda vo zvýšenej koncentrácii objavuje pri zvýšenej spotrebe energie a vo zvýšenej miere sa vyplavuje v oblastiach so zníženým tlakom vzduchu (vo vyšších nadmorských výškach). Viaže sa do dutiny medzi α a β podjednotami hemoglobínu, čím zvýrazňuje kooperativitu medzi týmito podjednotkami. Zvýraznenie kooperativity zabezpečuje, že sa na hemoglobín naviaže dostatočné množstvo kyslíka aj pri jeho nižšom parciálnom tlaku.
Oxid uhličitý a pH
Sekundárnou úlohou hemoglobínu v organizme je popri transporte kyslíku do tkanív transport oxidu uhličitého do pľúc. Tiež slúži (podobne ako všetky bielkoviny v krvi) ako molekula s vysokou pufračnou kapacitou. Väčšina oxidu uhličitého sa v krvi transportuje buď ako rozpustený plyn alebo v podobe hydrogénuhličitanového iónu, ktorý vzniká katalýzou karbón anhydrázou. 5 % sa však viaže na aminoskupinu lyzínu na hemoglobíne. Táto väzba mierne moduluje konformáciu kvartérnej štruktúry hemoglobínu a znižuje jeho afinitu ku kyslíku. Podobne znižuje afinitu kyslíku aj nízke pH, ktoré sa v krvi vyskytuje práve na miestach, kde pôsobí karbón anhydráza. Nízke pH a oxid uhličitý produkované v tkanivách teda prispievajú k výmene dýchacích plynov.
Prenatálne formy hemoglobínu
Prenatálne formy hemoglobínu majú oslabenú kooperativitu a preto majú pri nižšom parciálnom tlaku kyslíku k nemu vyššiu afinitu. Tento fakt je dôležitý pre dostatočné okysličenie plodu, ktorý tak vychytáva kyslík z krvi matky.
Formy hemoglobínu v rámci evolúcie
Všetky stavovce majú hemoglobín. Minimálne proteín podobný hemoglobínu majú aj všetky bezstavovce a niektoré huby a rastliny. Obdoba hemoglobínu, leghemoglobín, slúži v rastlinách žijúcich v symbióze s nitrifikačnými na vychytávanie kyslíku, ktorý inhibuje nitrifikačné enzýmy. Z hľadiska kvartérnej štruktúry sú najjednoduchšie hemoglobíny tvorené jedným polypeptidovým reťazcom s relatívnou molekulovou hmotnosťou okolo 16 kDa. Takýto polypeptidový reťazec tvorí jednu jednodoménovú podjednotku s jedným hemom a je súčasťou napríklad lariev pakomára pernatého, ktoré preto majú červenú farbu. Takéto hemoglobíny v agregovanej podobe sa vyskytujú u červov. Zložitejšie hemoglobíny (typické pre drobné kôrovce majú 5 - 8 polypeptidových reťazcov a relatívnu molekulovú hmotnosť až do 800 kDa a obsahujú dva hemy. Pre dážďovky a mäkkýše sú typické mnohodoménové a mnohopodjednotkové hemoglobíny s vysokým počtom hemov (8 - 20).[4]
Lokalizácia v organizme
Väčšina hemoglobínu v ľudskom tele sa syntetizuje v erytrocytoch, kde plní svoju základnú funkciu prenosu kyslíku a v ktorých zaujíma až 30 % z celkového objemu. Nachádza sa však aj v iných bunkách, konkrétne v alveoárnych bunkách pľúc, makrofágoch a menangiálnych bunkách, v ktorých plní funkciu antioxidantu a regulátoru metabolizmu železa. Funkcia rastlinných hemoglobínov nie je doposiaľ úplne objasnená, z hľadiska funkcie ich však môžeme rozdeliť na symbiotické hemoglobíny (napr. leghemoglobín, ktoré sú dôležité z hľadiska udržiavania symbiotického vzťahu medzi rastlinou a symbiontom, a nesymbiotické hemoglobíny, ktoré môžu slúžiť ako senzory koncentrácie kyslíku, môžu ovplyvňovať intracelulárny metabolizmus, viazať iné molekuly (oxid uhličitý, oxid dusnatý alebo byť súčasťou jednoduchého reťazca proteínov transportujúcich elektróny.[5]
Mutácie
.jpg.webp)
Mutácie génov pre podjednotky sú príčinou mnohých chorôb. Z hľadiska rozsahu mutácie sa ochorenia súvisiace s hemoglobínom delia na talasémie, pri ktorých jedincovi na jednom chromozóme chýba gén pre určitú podjednotku hemoglobínu a na ochorenia spôsobené tvorbou defektného hemoglobínu. Talasémie sa podľa chýbajúcej podjednotky rozdeľujú na α-talasémia a β-talasémie. Keďže gény pre α-podjednotku hemoglobínu obsahuje každá bunka štyri, ide o menej závažnú formu ochorenia. Delécia všetkých buď α- alebo β- podjednotiek hemoglobínu je letálna, napriek tomu plod prežíva často až do pôrodu, keďže využíva iné podjednotky. Mutácie v hemoglobíne sú veľmi časté a keďže väčšinou ide o jednobodovú mutáciu v zameniteľných aminokyselinách, nemajú väčšinou ani žiadne následky. Najznámejšia mutácia je zámena glutamátu za valín v pozícii B6, ktorej nositelia trpia mesiačikovitou anémiou. Tá sa prejavuje agregáciou hemoglobínov do útvarov v tvare mesiaca, kvôli čomu tento tvar nadobúdajú aj červené krvinky. Toto ochorenie je rozšírené predovšetkým v rovníkovej oblasti, pretože do istej miery poskytuje jej nositeľom rezistenciu proti v tejto geografickej polohe rozšírenej malárii. [6]
Iné krvné farbivá
Hemoglobín nie je jediné krvné farbivo, ktoré je schopné prenášať kyslík. Ďalšími prenášačmi kyslíku sú hemocyanín, ktorý viaže kyslík medzi dva atómy medi a hemerytrín, červený viažuci kyslík na nehemové železo. Oba tieto proteíny sú súčasťou väčšiny bezstavovcov.
Referencie
- NELSON, David L.; COX, Michael M.. Lehninger Principles of Biochemistry. 6. vyd. New York : W. H. Freeman and Company, 2013. ISBN 978-1-4641-0962-1. (anglicky)
- VOET, Donald; VOET, Judith G.. Biochemistry. 4. vyd. Hoboken, NJ : Wiley, 2010. ISBN 978-0470917459. (anglicky)
- JENSEN, Frank B. The dual roles of red blood cells in tissue oxygen delivery: oxygen carriers and regulators of local blood flow. Journal of Experimental Biology (The Company of Biologists), 2009, s. 3387–3393. DOI: 10.1242/jeb.023697. PMID 19837879.
- Weber RE, Vinogradov SN. Nonvertebrate hemoglobins: functions and molecular adaptations. Physiol. Rev., 2001, s. 569–628. Dostupné online. PMID 11274340.
- Hoy JA, Hargrove MS. The structure and function of plant hemoglobins. Plant Physiol Biochem., 2008, s. 371-379. DOI: 10.1016/j.plaphy.2007.12.016.
- A Syllabus of Human Hemoglobin Variants (1996). Globin.cse.psu.edu. Retrieved 2013-09-05.