Aminokyselina
Aminokyseliny alebo aminokarboxylové kyseliny sú organické zlúčeniny obsahujúce v molekule aminoskupinu (primárnu, sekundárnu či terciárnu) a karboxylovú skupinu (niekedy aj druhú aminoskupinu, druhú karboxyskupinu a ďalšie substinenty).
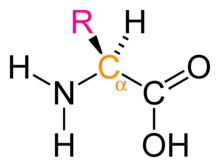
Podľa vzájomnej polohy aminoskupiny a karboxylovej skupiny sa rozlišujú a-, b-, g-aminokyseliny atď. Aminokyseliny kódované (proteinogénne, bielkovinotvorné) sú stavebnými jednotkami bielkovín. Ich zabudovanie do peptidového reťazca pri proteosyntéze je riadené genetickým kódom (preto kódované). Do tejto skupiny patrí 20 a-aminokyselín. Okrem glycínu ktorý nie je chirálny, majú všetky kódované aminokyseliny konfiguráciu L. Aminokyseliny nekódované nie sú pravidelnou súčasťou bielkovín. V organizme majú rôzne biologické funkcie, sú napr. súčasťou niektorých koenzýmov. Esenciálne aminokyseliny si telo nevie samo syntetizovať, musí ich získavať z potravy. Pre človeka sú esenciálne valín, leucín, izoleucín, fenylalanín, tryptofán, lyzín, metionín a treonín; ostatné sú neesenciálne.
Z metabolického hľadiska, to je podľa možností ich zapojenia do metabolizmu cukrov a tukov, sa delia na glukogénne (pri ich štiepení vznikajú medziprodukty metabolizmu cukrov), ketogénne (odbúravajú sa látky ktoré tvoria tuky) a glukogénne i ketogénne (štiepia sa zvyčajne na dva fragmenty, z ktorých jeden sa zapája do metabolizmu cukrov s druhý tukov). Biele kryštalické látky rozpustené vo vode, z väčšej časti vo forme amfiónov, napr. pri glycíne (+)NH3CH2COO(-). Majú amfortérny charakter (napr. tvoria sodné soli aj hydrochloridy) a prejavujú reakcie amínov (napr. acylácia) i karboxylových kyselín (napr. esterifikácia). Súčasná prítomnosť skupín NH2 a COOH umožňuje spojenie amidovou väzbou CONH a vznik laktámov, respektívne polyamidov. Najznámejším premyselne vyrábaným polyamidom je polyamid 6 (NH(CH2)5CO) n, vyrábaný z ekaprolaktámu. Prírodné polyamidy sú proteíny, v ktorých sa ako stavebné jednotky vyskytuje najčastejšie asi 20L-a-aminokykelín NH2CHCOOH líšiacich sa substituetom R.
Prehľad 20 základných proteinogénnych aminokyselín
Skratky a chemické vlastnosti
| Skr. | Celý názov | Typ postranného reťazca | Molová hmotnosť | pI | pK1 (α-COOH) |
pK2 (α-+NH3) |
pKr (R) | |
|---|---|---|---|---|---|---|---|---|
| A | Ala | Alanín | hydrofóbny | 89.09 | 6.11 | 2.35 | 9.87 | |
| C | Cys | Cysteín | hydrofóbny | 121.16 | 5.05 | 1.92 | 10.70 | 8.37 |
| D | Asp | Kyselina asparágová | kyslý | 133.10 | 2.85 | 1.99 | 9.90 | 3.90 |
| E | Glu | Kyselina glutámová | kyslý | 147.13 | 3.15 | 2.10 | 9.47 | 4.07 |
| F | Phe | Fenylalanín | hydrofóbny | 165.19 | 5.49 | 2.20 | 9.31 | |
| G | Gly | Glycín | hydrofilný | 75.07 | 6.06 | 2.35 | 9.78 | |
| H | His | Histidín | bázický | 155.16 | 7.60 | 1.80 | 9.33 | 6.04 |
| I | Ile | Izoleucín | hydrofóbny | 131.17 | 6.05 | 2.32 | 9.76 | |
| K | Lys | Lyzín | bázický | 146.19 | 9.60 | 2.16 | 9.06 | 10.54 |
| L | Leu | Leucín | hydrofóbny | 131.17 | 6.01 | 2.33 | 9.74 | |
| M | Met | Metionín | hydrofóbny | 149.21 | 5.74 | 2.13 | 9.28 | |
| N | Asn | Asparagín | hydrofilný | 132.12 | 5.41 | 2.14 | 8.72 | |
| P | Pro | Prolín | hydrofóbny | 115.13 | 6.30 | 1.95 | 10.64 | |
| Q | Gln | Glutamín | hydrofilný | 146.15 | 5.65 | 2.17 | 9.13 | |
| R | Arg | Arginín | bázický | 174.20 | 10.76 | 1.82 | 8.99 | 12.48 |
| S | Ser | Serín | hydrofilný | 105.09 | 5.68 | 2.19 | 9.21 | |
| T | Thr | Treonín | hydrofilný | 119.12 | 5.60 | 2.09 | 9.10 | |
| V | Val | Valín | hydrofóbny | 117.15 | 6.00 | 2.39 | 9.74 | |
| W | Trp | Tryptofán | hydrofóbny | 204.23 | 5.89 | 2.46 | 9.41 | |
| Y | Tyr | Tyrozín | hydrofóbny | 181.19 | 5.64 | 2.20 | 9.21 | 10.46 |
Aminokyseliny sa v bežnej praxi označujú skratkami. V biochémii sa vačšinou používajú trojpísmenové skratky. Jednopísmenové skratky sa používajú hlavne na zapisovanie sekvencie bielkovín.
Prehľad chemickej štruktúry
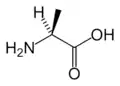 Ala
Ala.png.webp) Arg
Arg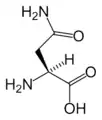 Asn
Asn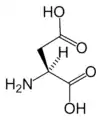 Asp
Asp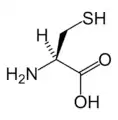 Cys
Cys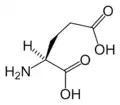 Glu
Glu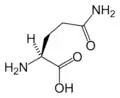 Gln
Gln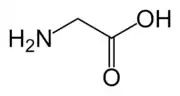 Gly
Gly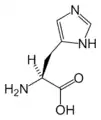 His
His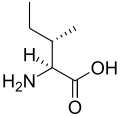 Ile
Ile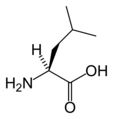 Leu
Leu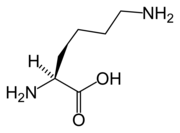 Lys
Lys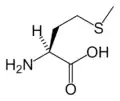 Met
Met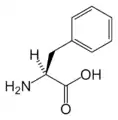 Phe
Phe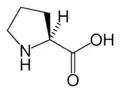 Pro
Pro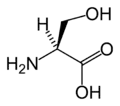 Ser
Ser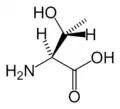 Thr
Thr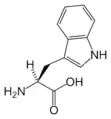 Trp
Trp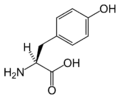 Tyr
Tyr Val
Val
Ďalšie aminokyseliny v živých objektoch
Okrem 20 základných proteinogénnych aminokyselín sa v bielkovinách môžu nachádzať aj ďalšie aminokyseliny, ktoré vznikajú druhotne, úpravou už hotovej bielkoviny. Takýmito aminokyselinami sú napr. hydroxy-prolín, a N-trimetyl-lyzín.
V živých objektoch sa prirodzene nachádzajú aj neproteinogénne aminokyseliny, väčšinou ako medziprodukty metabolizmu aminokyselín. Takýmito aminokyselinami sú napr. homoserín, homocysteín, ornitín, citrulín a iné).
Syntéza aminokyselín
Rastliny dokážu syntetizovať všetky aminokyseliny z anorganických látok. Naproti tomu živočíchy si dokážu tvoriť len niektoré aminokyseliny (a aj to len premenou iných, hotových aminokyselín), iné (tvz. esenciálne aminokyseliny) musia dostávať hotové z potravy.
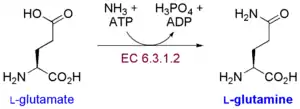
Dusík potrebný na produkciu aminokyselín získavajú rastliny z pôdy vo forme dusičnanov, alebo amoniaku. Dusičnany sa redukujú na amoniak dvojicou enzýmov nitrát reduktázou a nitrit reduktázou. Amoniak sa zabudováva pomocou enzýmov GS (glutamín syntetáza) a GOGAT (glutamát syntáza, nazývaná tiež glutamín-oxoglutarát-aminotransferáza). Produktom je glutamín (Gln) a kyselina glutámová (Glu). Z nich sa potom vytvárajú všetky ostatné aminokyseliny.
Iné projekty
 Commons ponúka multimediálne súbory na tému Aminokyselina
Commons ponúka multimediálne súbory na tému Aminokyselina
| Chemický portál Biologický portál |