Karboxylová kyselina
Karboxylové kyseliny sú organické zlúčeniny s karboxylovou funkčnou skupinou -COOH.
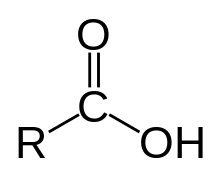
Radia sa medzi kyslíkaté deriváty organických zlúčenín. V názvoch zlúčenín sa prítomnosť karboxylovej funkčnej skupiny vyjadruje predponou karboxy- alebo príponou -ová kyselina. Sú to Brønstedove kyseliny, teda fungujú ako donor vodíkového protónu H+.
Fyzikálne vlastnosti
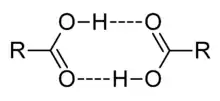
Karboxylové kyseliny majú vyššie body varu a body topenia, ako by sa dalo usúdiť podľa ich mólovej hmotnosti. Je to spôsobené tým, že vytvárajú silné medzimolekulové vodíkové väzby. Sú omnoho slabšie kyseliny ako minerálne kyseliny. Ich disociačné konštanty sú zhruba o päť rádov nižšie. V porovnaní s alkoholmi sú asi silnejšími kyselinami. V infračervených spektrách sú karboxylové kyseliny charakteristické singálmi v okolí 1700 cm−1 (karbonyl C=O) a v okolí 3000 cm−1 (hydroxyl O-H)
Syntéza
Karboxylové kyseliny sa zvyčajne vyrábajú oxidáciou primárnych alkoholov a aldehydov, za prítomnosti vhodých oxidačných činidiel, akými sú napr. manganistan draselný alebo oxid chrómový v kyslom prostredí. Možno ich pripraviť hydrolýzou ich esterov alebo solí.
Reakcie
Karboxylové kyseliny reagujú s alkalickými hydroxidmi za vzniku solí:
- R-COOH + NaOH → R-COONa + H2O
Soli karboxylových kyselín môžu reagovať s alkylhalogenidmi za vzniku esterov:
- R-COONa + R'-Br → R-COOR' + NaBr
- R-COOAg + R'-I → R-COOR' + AgI
S roztokom hydroxidu amónneho dávajú amónne soli, ktoré možno ďalej zahriatím previesť za odštiepenia vody na amidy kyselín:
- R-COOH + NH4OH → R-COO-NH4 → R-CO-NH2 + H2O
Karboxylové kyseliny sú schopné reagovať priamo s amínmi:
- R-COOH + NH2-R' → R-CO-NH-R' + H2O
S tionylchloridom alebo chloridmi fosforu dávajú príslušné chloridy kyselín:
- R-COOH + SOCl2 → R-CO-Cl + SO2 + HCl
- R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
- 3 R-COOH + PCl3 → 3 R-CO-Cl + P(OH)3 + HCl
Esterifikácia karboxylových kyselín prebieha ako nukleofilná substitučná reakcia. Cez reakčný mechanizmus možno ukázať, že atóm kyslíka, ktorým sa napája alkoholový zvyšok, pochádza z molekuly alkoholu, nie z molekuly karboxylovej kyseliny:
- R-COOH + HO-R' → R-CO-O-R'
Zahriatím dávajú anhydridy kyselín.
Zoznam najbežnejších karboxylových kyselín
Monokarboxylové kyseliny alkánov
Nasýtené:
- kyselina mravčia (metánová) - H-COOH
- kyselina octová (etánová) - CH3-COOH
- kyselina propiónová (propánová) - CH3-CH2-COOH
- kyselina maslová (butánová) - CH3-(CH2)2-COOH
- kyselina valérová (pentánová) - CH3-(CH2)3-COOH
- kyselina kaprónová (hexánová) - CH3-(CH2)4-COOH
Nenasýtené:
- kyselina akrylová (propénová) - CH2=CH-COOH
- kyselina olejová (9-oktadecénová) - CH3-(CH2)7-CH=CH-(CH2)7-COOH
Dikarboxylové kyseliny alkánov
- kyselina šťaveľová (oxálová, etándiová) - HOOC-COOH
- kyselina malónová (propándiová) - HOOC-CH2-COOH
- kyselina jantárová - HOOC-(CH2)2-COOH
- kyselina glutárová - HOOC-(CH2)3-COOH
- kyselina adipová - HOOC-(CH2)4-COOH
- kyselina pimelová - HOOC-(CH2)5-COOH
- kyselina korková (suberová) - HOOC-(CH2)6-COOH
Vyššie karboxylové kyseliny/ Mastné kyseliny
Sú viazané v lipidoch.
- kyselina palmitová (hexadekánová) - CH3-(CH2)14-COOH
- kyselina steárová (oktadekánová) - CH3-(CH2)16-COOH
- kyselina olejová (cis-oktadec-9-énová) - CH3-(CH2)7-CH=CH-(CH2)7-COOH
- kyselina linolová (cis, cis-oktadeka-9,12-diénová) - CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH
- kyselina linolénová - CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)7-COOH
Aromatické karboxylové kyseliny
Obsahujú aromatické benzénové jadro.
- kyselina benzoová - kyselina benzénkarboxylová
- kyselina ftalová - kyselina benzén 1,2- dikarboxylová
- kyselina tereftalová
- kyselina salicylová
Hydroxykyseliny
Okrem karboxylovej skupiny obsahujú ešte aspoň jednu hydroxylovú skupinu.
- kyselina mliečna
- kyselina vínna
- kyselina glukónová
- kyselina glukarová
Kyseliny s dvojitými väzbami C=C
- kyselina maleinová (cis-buténdiová)
- kyselina fumarová (trans-buténdiová)
Aminokyseliny
Sú to substitučné deriváty karboxylových kyselín s funkčnou skupinou -NH2 na alfa-uhlíku.
| Chemický portál |