Silanol
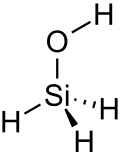
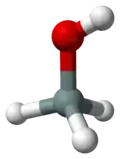
Silanol (také silylalkohol) je těžká, nestálá, bezbarvá hořlavá kapalina. Její vzorec je SiH3OH. Při pokojové teplotě se chová jako polární kapalina. Ze všech silanolů je nejjednodušší.
| Silanol | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Silanol |
| Ostatní názvy | Silikol Silylalkohol |
| Sumární vzorec | H4OSi |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 14475-38-8 |
| Vlastnosti | |
| Molární hmotnost | 48,1 g/mol |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Silanol hoří na vzduchu za vzniku oxidu křemičitého a vody.
- 2 SiH3OH + 3 O2 → 2 SiO2 + 4 H2O
Silanoly jsou sloučeniny obsahující křemík, na který je vázána jedna nebo více hydroxylových skupin. Stejně jako silany jsou podobné alkanům, tak i silanoly jsou podobné alkanolům.
Když je hydroxylová skupina v silanolu hlavní, tvoří se názvy silanolů příponou -ol z názvů silanů. Pokud je hydroxylová skupina vedlejší, tvoří se jejich názvy pomocí přípony hydroxyl- podle substituční klasifikace. Tato pravidla jsou téměř stejná jako u alkoholů, s tím rozdílem, že se názvy nevytvářejí od alkanů, ale od silanů.
Historie
Silanoly byly poprvé připraveny v roce 1871 německým chemikem Albertem Ladenburgem. První z nich byl triethylsilanol.
Příprava
Silanoly jsou obvykle syntetizovány hydrolýzou halosilanů a alkosylilanů nebo aminosilanů; oxidací hydrosilanů nebo hydrolýzou arylsilanů v přítomnosti silné kyseliny.
Vlastnosti
Silanoly se obecně velmi snadno dehydratují, mění se v disiloxany v přítomnosti kyseliny, zásady nebo dokonce tepla. Je velmi těžké je vyrobit a izolovat, protože podléhají samovolné kondenzaci. Silanoly mají vodíkové můstky v roztocích a dokonce i v krystalech. Silanoly mohou být spojovány pomocí boraxu nebo kyseliny borité k vytvoření trojrozměrných silikonových gelů.
Silanoly nejsou jen chemikáliemi, ale vznikají také na povrchu křemene. Ze strany organokovové chemie, křemen může být považován za významný ligand a používá se pro podporu katalyzátorů v mnoha chemických reakcích.