Kyselina trifluormethansulfonová
Kyselina trifluormethansulfonová (zkráceně TFMS, TFSA, HOTf nebo TfOH) je sulfonová kyselina, fluorderivát kyseliny methansulfonové. Patří k nejsilnějším známým kyselinám. Tato kyselina se nejčastěji používá ve výzkumu jako katalyzátor esterifikace.[2][3] Jedná se o hygroskopickou bezbarvou kapalinu rozpustnou v polárních rozpouštědlech.
| Kyselina trifluormethansulfonová | |
|---|---|
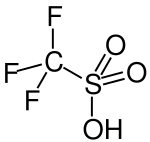
Strukturní vzorec | |

Tyčinkovo-kuličkový model molekuly | |
Kalotový model molekuly | |
| Obecné | |
| Systematický název | Kyselina trifluormethansulfonová |
| Anglický název | Trifluoromethanesulfonic acid (systematický název) Triflic acid |
| Sumární vzorec | CF3SO3H |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 1493-13-6 |
| PubChem | 62406 |
| ChEBI | 48511 |
| SMILES | C(F)(F)(F)S(=O)(=O)O |
| InChI | 1S/CHF3O3S/c2-1(3,4)8(5,6)7/h(H,5,6,7) |
| Vlastnosti | |
| Molární hmotnost | 150,08 g/mol |
| Teplota tání | −40 °C (233 K |
| Teplota varu | 162 °C (439 K) |
| Disociační konstanta pKa | −14,7±2,0 |
| Rozpustnost ve vodě | mísitelná |
| Rozpustnost v polárních rozpouštědlech |
rozpustná v acetonitrilu a kyselině octové |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Kyselina trifluormethansulfonová se průmyslově vyrábí elektrochemickou fluorací kyseliny methansulfonové:
- 2 CH3SO3H + 8 HF → 2 CF3SO2F + 2 H2O + 3 H2
a následnou hydrolýzou vzniklého CF3SO2F. Dalším možným způsobem je oxidace trifluormethylsulfenylchloridu:[4]
- CF3SCl + 2 Cl2 + 3 H2O → CF3SO3H + 5 HCl
Kyselina vzniklá jedním z těchto způsobů se poté přečišťuje převedením na anhydrid, destilací a opětovnou přeměnou anhydridu na kyselinu.[3]
Historický způsob výroby
Kyselina trifluormethansulfonová byla poprvé syntetizována Robertem Haszeldinem a J.M. Kiddem v roce 1954, a to následující reakcí:[5]
Použití a reakce
Jako kyselina
V laboratoři se využívá skutečnosti, že TfOH je dobrým protonačním činidlem, jelikož její konjugovaná zásada není nukleofilní. Také se používá při nevodných acidobazických titracích, protože se chová jako silná kyselina v mnoha rozpouštědlech (například acetonitrilu, kyselině octové atd.), v nichž jsou běžné minerální kyseliny (jako například HCl a H2SO4) pouze středně silné nebo slabé.
Vzhledem k hodnotě Ka (disociační konstanty) 5×1014, pKa = −14,7±2,0,[6] se tato kyselina řadí mezi superkyseliny. Má řadu užitečných vlastností jako jsou značná chemická a teplotní stabilita. Jak samotná kyselina, tak i její konjugovaná zásada CF3SO −
3 , známá jako triflát, jsou odolné vůči oxidačním a redoxním reakcím, zatímco má většina silných kyselin, jako kyselina chlorečná a kyselina dusičná, oxidující účinky. Rovněž nezpůsobuje sulfonaci substrátů, což může být problém při použití kyseliny sírové, fluorsírové či chlorsulfonové. Níže je uvedena typická sulfonace, která u HOTf neprobíhá:
- C6H6 + H2SO4 → C6H5(SO3H) + H2O
Výpary kyseliny trifluormethansulfonové na vlhkém vzduchu vytvářejí stabilní pevný monohydrát, CF3SO3H·H2O, jehož teplota tání činí 34 °C.
Tvorba solí a komplexů
Triflátový ligand je, v souladu se svou nízkou zásaditostí, nestabilní. Kyselina trifluormethansulfonová reaguje exotermně s uhličitany, hydroxidy a oxidy kovů. Příkladem může být příprava Cu(OTf)2.[7]
Chloridové ligandy se dají převést na odpovídající trifláty:
- 3 CF3SO3H + [Co(NH3)5Cl]Cl2 → [Co(NH3)5O3SCF3](O3SCF3)2 + 3 HCl
Tato přeměna probíhá v čisté HOTf při 100 °C a je následována vysrážením soli po přídavku etheru.
V organické chemii
Kyselina trifluormethansulfonová reaguje s acylhalogenidy za vzniku smíšených triflátových anhydridů, které jsou silnými acylačními činidly, používanými například při Friedel-Craftsově acylaci:
- CH3C(O)Cl + CF3SO3H → CH3C(O)OSO2CF3 + HCl
- CH3C(O)OSO2CF3 + C6H6 → CH3C(O)C6H5 + CF3SO3H
HOTf katalyzuje reakci aromatických sloučenin se sulfonylchloridy, pravděpodobně přes meziprodukt v podobě smíšeného anhydridu se sulfonovou kyselinou.
Kyselina trifluormethansulfonová podporuje další podobné reakce, například krakování alkanů a alkylaci alkenů, které jsou důležité v petrochemickém průmyslu. Katalyzátory tvořené deriváty kyseliny trifluormethansulfonové jsou velmi účinné při izomerizaci nerozvětvených či málo rozvětvených řetězců uhlovodíků, čímž se zvyšuje oktanové číslo příslušného paliva.
Kyselina trifluormethansulfonová exotermně reaguje s alkoholy za vzniku etherů a alkenů.

Ostatní
Dehydratací TfOH vznikne její anhydrid, triflylanhydrid (CF3SO2)2O.
Bezpečnost
Kyselina trifluormethansulfonová je jednou z nejsilnějších známých kyselin. Dotyk s kůží může způsobit vážná poranění s opožděným poškozením tkáně. Vdechnutí výparů této kyseliny způsobuje křeče, záněty a otoky.[8]
Přidání TfOH do polárních rozpouštědel může být až nebezpečně exotermní.
Reference
V tomto článku byl použit překlad textu z článku Triflic acid na anglické Wikipedii.
- Trifluoromethanesulfonic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Howells, R. D., McCown, J. D. Trifluoromethanesulfonic Acid and Derivatives. Chemical Reviews. 1977, s. 69–92. DOI 10.1021/cr60305a005. (anglicky)
- SUBRAMANIAN, L. R.; MARTINEZ, A. G.; HANACK, M.; PRAKASH, G. K. S.; HU, J. Encyclopedia of Reagents for Organic Synthesis. Trifluoromethanesulfonic Acid. [s.l.]: John Wiley & Sons, 2006. ISBN 0-471-93623-5. DOI 10.1002/047084289X.rt246.pub2. (anglicky)
- Siegemund, G.; SCHWERTFEGER, W.; FEIRING, A.; SMART, B.; BEHR, F.; VOGEL, H.; MCKUSICK, B. Ullmann's Encyclopedia of Industrial Chemistry. Fluorine Compounds, Organic. [s.l.]: John Wiley & Sons, 2000. DOI 10.1002/14356007.a11_349. (anglicky)
- Haszeldine, R. N.; KIDD, J. M. Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid. Journal of the Chemical Society. 1954, s. 4228–4232. DOI 10.1039/JR9540004228. (anglicky)
- Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, I. A.; Leito, I. "Acidity of Strong Acids in Water and Dimethyl Sulfoxide" J. Phys. Chem. A. 2016, 120, 3663-3669. DOI:10.1021/acs.jpca.6b02253
- Dixon, N. E.; LAWRANCE, G. A.; LAY, P. A.; SARGESON, A. M.; TAUBE, H. Trifluoromethanesulfonates and trifluoromethanesulfonato-O complexes. Inorganic Syntheses. 1990, s. 70–76. ISBN 978-0-470-13259-3. DOI 10.1002/9780470132593.ch16. (anglicky)
- Trifluoromethanesulfonic acid MSDS [online]. ChemCAS. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina trifluormethansulfonová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina trifluormethansulfonová na Wikimedia Commons


