Isopropylalkohol
Isopropylalkohol (systematický název propan-2-ol; též znám jako 2-propanol, isopropanol, izopropylalkohol, izopropanol, iso, isopro, IPA) je organická sloučenina se sumárním vzorcem C3H8O. Je to nejjednodušší příklad sekundárního alkoholu, kde je alkoholový uhlík vázán se dvěma dalšími uhlíky. Společně s 1-propanolem je izomerem propanolu. Jedná se o bezbarvou, hořlavou kapalinu charakteristického zápachu. Používá se jako čistidlo a odmašťovač.
| Isopropylalkohol | |
|---|---|
 | |
| Obecné | |
| Systematický název | Propan-2-ol |
| Triviální název | Isopropylalkohol |
| Ostatní názvy | Isopropanol |
| Anglický název | Isopropyl alcohol |
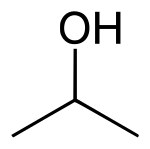
| Funkční vzorec | (CH3)2CHOH |
| Sumární vzorec | C3H8O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 67-63-0 |
| EC-no (EINECS/ELINCS/NLP) | 200-661-7 |
| Indexové číslo | 603-117-00-0 |
| SMILES | CC(O)C |
| Vlastnosti | |
| Molární hmotnost | 60,1 g/mol |
| Teplota tání | −89 °C |
| Teplota varu | 82,3 °C |
| Hustota | 0,786 g/cm3 (20 °C, kapalina) |
| Viskozita | 2,86 cP (15 °C), 1,96 cP (25 °C), 1,77 cP (30 °C) |
| Disociační konstanta pKa | 16,5 |
| Struktura | |
| Dipólový moment | 1,66 D (plyn) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H319 H336 |
| R-věty | R11 R36 R67 |
| S-věty | S7 S16 S24 S25 S26 |
| NFPA 704 |  3
1
|
| Teplota vzplanutí | 11,7 °C (uzavřený kelímek) 17 °C (otevřený kelímek)[2] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Isopropylalkohol se vyrábí z vody a propenu.[3] Existují dva procesy, které lze použít: nepřímá hydratace pomocí kyseliny sírové a přímá hydratace. První z procesů, při kterém lze používat méně kvalitní propylen, dominuje ve Spojených státech, kdežto druhý z procesů (vyžadující velmi čistý propylen) je běžně používán v Evropě. V obou procesech jako produkt převažuje propan-2-ol nad propan-1-olem, protože přídavek vody nebo kyseliny sírové vede k procesu podle Markovnikovova pravidla.
V nepřímém procesu reaguje propylen s kyselinou sírovou za vzniku směsi síranových esterů. Následná hydrolýza těchto esterů produkuje isopropylalkohol. V přímé hydrataci reaguje propylen a voda, ať už v plynné nebo kapalné fázi, za vysokých tlaků a za přítomnosti pevných nebo kyselých katalyzátorů. Oba procesy vyžadují, aby byl isopropylalkohol izolován z vody a vedlejších produktů destilací. Isopropylalkohol a voda tvoří azeotropickou směs a jednoduchá destilace dává směs s 87,9 % (hmotnostně) isopropylalkoholu a 12,1 % vody.[4] Čistý (bezvodý) isopropylalkohol je produkován azeotropní destilací „mokrého“ isopropylalkoholu buď s diisopropyletherem, nebo cyklohexanem jako azeotropními činidly.
Použití
Isopropylalkohol je snadno dostupný[zdroj?]. Podobně jako aceton rozpouští širokou škálu nepolárních sloučenin. Je relativně netoxický a rychle se odpařuje. Proto se široce používá jako rozpouštědlo a jako čisticí prostředek (pro rozpouštění lipofilních kontaminantů, například oleje). Příkladem je použití k čištění elektronických zařízení – elektrických kontaktů (například u paměťových karet), magnetických hlav u páskových a disketových mechanik, čoček laserů u optických mechanik (CD, DVD), k odstraňovaní teplovodivé pasty z CPU apod. Používá se i k čištění LCD a skleněných obrazovek (s určitým rizikem pro antireflexní vrstvu na povrchu obrazovky), hudební obchody s ním často leští bazarové nebo poškrábané gramofonové desky. Čistí se s ním bílé tabule a odstraňují nechtěné inkoustové značky (s rizikem poškození povrchu). Používá se i k čištění zbraní. Též dobře odstraňuje šmouhy, špínu a otisky prstů z mobilních telefonů a PDA. Je účinný při odstraňování zbytků lepidel po nálepkách. Lze ho použít i pro odstraňování skvrn z většiny látek, dřeva, bavlny apod.
Jako konzervant (pro biologické preparáty) isopropylalkohol poskytuje levnou (v porovnání s čistým ethanolem) a srovnatelně netoxickou alternativu k formaldehydu a jiným syntetickým konzervantům. Optimální koncentrace je 90 až 99 %, v nouzi lze použít i koncentraci 75 %.[5]
Dezinfekční polštářky typicky obsahují 60–70% roztok isopropylalkoholu ve vodě. Běžně se používá i jako průmyslový čistič a rozpouštědlo.
Isopropylalkohol je hlavní složkou aditiv pro odvodňování benzinu. Voda ve významnějších množstvích představuje v palivových nádržích problém, protože se odděluje a může v palivové soustavě zamrznout. Neodstraní vodu z benzinu, způsobí však, že se rozpustí. Rozpuštěná voda už nepředstavuje takové nebezpečí jako voda nerozpuštěná, protože už nemůže zamrznout v palivovém potrubí. Isopropylalkohol se také často prodává jako sprej na odmrazování čelního skla dopravních prostředků.
Isopropylalkohol se používá jako odstraňovač vody pro léčbu zánětu zvukovodu, známého též jako plavecké ucho.[6]
V ofsetovém tisku se používá jako přísada pro snížení povrchového napětí vlhčicího roztoku (u moderních vlhčicích systémů do 5 %). Díky tomu se na vlhčicích válcích vytváří film větší tloušťky což pomáhá zajistit dostatečné navlhčení tiskové formy.
Chemie
Na rozdíl od ethanolu a methanolu lze isopropylalkohol oddělit z vodných roztoků přidáním soli, například chloridu sodného, síranu sodného nebo jakékoli z mnoha dalších anorganických solí.[7] Proces se běžně nazývá vysolování a způsobuje, že se koncentrovaný isopropylalkohol oddělí do samostatné vrstvy.
Jakožto sekundární alkohol lze isopropylalkohol oxidovat na keton, aceton. To lze provést oxidačním činidlem, například kyselinou chromovou, anebo dehydrogenací isopropylalkoholu při katalýze horkou mědí:
Isopropylalkohol lze převést na 2-brompropan pomocí bromidu fosforitého nebo dehydratovat na propen zahříváním s kyselinou sírovou.
Isopropylalkohol se často používá jako zdroj hydridu v Meerwein-Ponndorf-Verleyově redukci.
Podobně jako většina alkoholů reaguje isopropylalkohol s aktivními kovy, například draslíkem, za tvorby alkoxidů, které se nazývají isopropoxidy. Reakce s hliníkem (iniciovaná stopami rtuti) se používá k přípravě katalyzátoru isopropoxidu hlinitého.
Isopropylalkohol má maximální absorbanci na vlnové délce 204 nm v ultrafialovém spektru.
Měrná tepelná kapacita je při 20 °C 2,6 kJ/(kg.K), skupenské teplo tání 89 kJ/kg, skupenské teplo varu 664 kJ/kg.
Bezpečnost
Páry isopropylalkoholu jsou těžší než vzduch a jsou snadno zápalné v širokém rozsahu koncentrací. Isopropylalkohol je nutno uchovávat mimo zdroje žáru a otevřený oheň. Směs se vzduchem nebo s jinou oxidující látkou je výbušná.[8] O isopropylalkoholu se také uvádí, že může tvořit výbušné peroxidy.[8][9] V ČR za poslední desetiletí takto došlo k amputacím minimálně u dvou laboratorních pracovníků, proto nelze manipulovat (seškrabávat) případné krystaly v nádobách s isopropylalkoholem.[10]
Toxikologie
Isopropylalkohol se při požití vstřebá z 80 % během 30 minut, úplně pak do 2 hodin; při požití velkého množství to ale může trvat i déle. Taktéž rozptýlení do všech tkání trvá až 2 hodiny. Isopropylalkohol se velmi snadno vstřebává do krve při vdechování jeho par, prochází do těla také kůží (i neporušenou).[2]
V organismu se isopropylalkohol oxiduje alkoholdehydrogenázou v játrech na aceton. Jeho osud je v zásadě podřízen kinetice prvního řádu (eliminace s konstantním poločasem), eliminační poločas je 2,5 až 3,2 hodiny. Podstatně pomalejší je však eliminace vzniklého acetonu, u člověka je poločas 22,4 hodiny (pro srovnání: potkan cca 5 hodin). 20 až 50 % isopropylalkoholu se vylučuje v nezměněné podobě.[2]
Isopropylalkohol silně dráždí oči a sliznice. Způsobuje útlum CNS, ve velkých dávkách tlumí také kardiovaskulární systém. Tlumivě na CNS působí i metabolit aceton, čímž se zesiluje a prodlužuje tlumivý účinek. Eliminace acetonu může vyvolat mírnou acidózu (vznik acetátu a formiátu). Posun NAD/NADH může tlumit glukoneogenezi a vést tak k hypoglykémii – ta je zvlášť těžká u dětí při špatné výživě, hubnutí nebo po zátěži. Mohou se objevit příznaky opilosti, periferní vazodilatace a hypotermie.[2] V dechu může být ovocný pach jako důsledek tvorby acetonu, který nebyl dále zmetabolizován.[11]
U potkanů byla zjištěna teratogenita (snížená váha plodu a častější malformace kostry). Karcinogenní ani mutagenní účinky nebyly prokázány. Isopropylalkohol zvyšuje jaterní a ledvinovou toxicitu halogenderivátů uhlovodíků.[2]
Mezi příznaky intoxikace patří zčervenání, bolesti hlavy, dezorientace, závratě, útlum CNS, bolest břicha, křeče, nausea, zvracení, hypotenze, tachykardie, anestezie, ztráta šlachových reflexů a kóma, případně smrt.
I když dávka 15 g isopropylalkoholu může být bez léčby smrtelná, isopropylalkohol není zdaleka tak toxický jako methanol nebo ethylenglykol.[12]
Neexistuje specifické antidotum. Při požití lze během prvních 30 minut odstranit malé dávky vyvoláním zvracení (ne v případě většího množství nebo při porušení vědomí), u větších se používá výplach žaludku. Požitý isopropylalkohol lze vázat pomocí aktivního uhlí (1 g absorbuje cca 0,5 g isopropylalkoholu). Další léčba je především podpůrná, zaměřená na péči o základní životní funkce a úpravu biochemické nerovnováhy (doplňování vody a elektrolytů, korekce acidózy). Podává se také dopamin. V těžkých případech lze odstranit látku z těla pomocí hemodialýzy.[2]
Bod tuhnutí vodných roztoků
| Koncentrace isopropanolu (obj. %) |
0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Teplota (°C) | 0 | −4 | −7 | −15 | −18 | −21 | −23 | −29 | −37 | −57 | −90 |
[zdroj?]
Reference
V tomto článku byl použit překlad textu z článku Isopropyl alcohol na anglické Wikipedii.
- Isopropyl alcohol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Isopropyl alcohol - International Programme on Chemical Safety - Poisons Information Monograph 290
- Kirk‑Othmer Encyclopedia of Chemical Technology. [s.l.]: John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000. Kapitola Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke.
- CRC Handbook of Chemistry and Physics, 44th ed. pp 2143-2184
- KAMPF, G.; TODT, D.; PFAENDER, S. Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. Journal of Hospital Infection. 2020-03-01, roč. 104, čís. 3, s. 246–251. PMID: 32035997. Dostupné online [cit. 2022-05-08]. ISSN 0195-6701. DOI 10.1016/j.jhin.2020.01.022. PMID 32035997. (English)
- www.mcw.edu [online]. [cit. 01-01-2009]. Dostupné v archivu pořízeném dne 26-02-2010.
- Merck Index of Chemicals and Drugs, 9th ed. monograph 5069
- Safety (MSDS) data for 2-propanol [online]. Oxford University [cit. 2006-09-28]. Dostupné online.
- Hess, R. K. Chemical Safety Hazard Alert - Isopropanol, Peroxides Result in Explosion & Injury [online]. Brookhaven National Laboratory, 1997-06-09 [cit. 2009-01-01]. Dostupné v archivu pořízeném dne 2008-10-19.
- Pozor na isopropylalkohol | MPO. www.mpo.cz [online]. [cit. 2022-05-08]. Dostupné online.
- Tiess, D: Z. ges. Hygiene 31, 530-531 (1985)
- Calculated from TDLO listed at Oxford University MSDS, assuming weight of 70 kg
Externí odkazy
 Obrázky, zvuky či videa k tématu Isopropylalkohol na Wikimedia Commons
Obrázky, zvuky či videa k tématu Isopropylalkohol na Wikimedia Commons - The US government's Occupational Safety and Health Administration's guidelines for isopropyl alcohol.
- MSDS sheet for Isopropyl Alcohol
- Vapor pressure and liquid density calculation
- Lab Manager Article on Working with Isopropyl Alcohol
- Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents

