Mravenčany
Mravenčan (neboli formiát či methanoát) je sůl kyseliny mravenčí. Většina z nich je ve vodě dobře rozpustná. Výraz formiát se také používá pro estery kyseliny mravenčí.
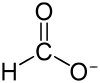
Výroba
Většinu mravenčanů lze připravit reakcí kyseliny s kovem. Příklady těchto reakcí jsou:
Reakce takto probíhá se všemi kovy, které jsou v Beketovově řadě kovů nalevo od vodíku, tedy reaktivnější, než je vodík. Reakce probíhají i se solemi slabých kyselin (nebo s hydroxidy či oxidy) kovů ušlechtilých i neušlechtilých:
Pro reakci s čistými ušlechtilými kovy je třeba použít oxidační činidlo, vhodným příkladem je zejména peroxid vodíku:
Při přebytku peroxidu vodíku se však mravenčan začne rozpadat za vzniku černého oxidu měďnatého a malého množství nazelenalého uhličitanu měďnatého, které reagují s kyselinou mravenčí.
Vznik esterů
Kyselina mravenčí reaguje s příslušným alkoholem a vzniká ester, přičemž se ještě odštěpí z karboxylové skupiny OH, a z alkoholové skupiny H, čímž vznikne voda. Tato reakce probíhá sama, díky oxoniovým iontům v kyselině mravenčí, nicméně reakce probíhá podstatně rychleji za přítomnosti silné kyseliny, obvykle kyseliny sírové, která napomáhá při odštěpování vody. Reakce probíhá takto:
Příklady
- mravenčan sodný HCOONa
- mravenčan draselný HCOOK
- mravenčan vápenatý (HCOO)2Ca
- mravenčan hořečnatý (HCOO)2Mg
- mravenčan hlinitý (HCOO)3Al
Estery
- mravenčan methylnatý HCOOCH3
- mravenčan ethylnatý HCOOC2H5