Hexafluorfosforečnany
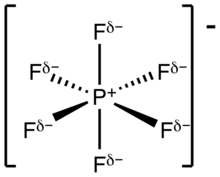
Hexafluorfosforečnany jsou soli obsahující hexafluorfosforečnanový anion PF -
6 , jejich molekuly bývají oktaedrické. PF -
6 má stejnou elektronovou konfiguraci jako fluorid sírový (SF6), hexafluorokřemičitanový anion SiF 2-
6 a fluoroantimoničnanový anion SbF -
6 . Jelikož je slabým nukleofilem, tak bývá řazen mezi nekoordinující anionty.[1][2]
Příprava

Hexafluorfosforečnany lze připravit reakcí chloridu fosforečného s halogenidem alkalického kovu nebo amonného kationtu v kyselině fluorovodíkové:[3]
- PCl5 + MCl + 6 HF → MPF6 + 6 HCl
Kyselinu hexafluorfosforečnou je možné získat reakcí fluorovodíku s fluoridem fosforečným:[4]. Jedná se o silnou Brønstedovu kyselinu, obvykle připravovanou krátce před použitím.
- PF5 + HF → HPF6
K bezpečnému provedení těchto reakcí a omezení nebezpečnosti kyseliny fluorovodíkové a fluorovodíku je třeba zvláštní vybavení.
Stanovení
Bylo vyvinuto několik metod stanovení koncentrace hexafluorfosforečnanových iontů. Tetrafenylarsoniumchlorid, [(C6H5)4As]Cl, je možné použít při titračním[5] i gravimetrickém stanovení.[6] Tyto postupy jsou založeny na tvorbě hexafluorfosforečnanu tetrafenylarsonia:
- [(C6H5)4As]+ + PF -
6 → [(C6H5)4As]PF6
Koncentraci hexafluorfosforečnanů je rovněž možné určit spektrofotometricky pomocí ferroinu.[7]
Reakce
Hydrolýza hexafluorfosforečnanů v zásaditém prostředí probíhá velmi pomalu,[8] což platí také v kyselých roztocích.[9] Rozklad hexafluorfosforečnanů za vzniku fluorovodíku ovšem lze provést v iontových kapalinách.[10]
Organokovová a anorganická syntéza
Hexafluorfosforečnanový anion je častým protiiontem u kationtových komplexů kovů. Je, společně s tetrafluorboritanovým (BF -
4 ) a chloristanovým (ClO -
4 ) jedním ze tří často používaných nekoordinujících aniontů; z těchto tří iontů má nejslabší sklony k tvorbě komplexů.[11]
Hexafluorfosforečnany lze připravit reakcemi hexafluorofosforečnanu stříbrného s halogenidy, přičemž vysrážení stříbrného halogenidu usnadňuje provedení reakce. Protože jsou hexafluorfosforečnany často nerozpustné ve vodě, ale rozpustné v polárních organických rozpouštědlech, tak přidání i malého množství hexafluorofosforečnanu amonného (NH4PF6) do vodných roztoků řady anorganických i organických solí způsobí vysrážení hexafluorfosforečnanů; příkladem je příprava solí rhodocenia:[12]
- RhCl3·xH2O + 2 C5H6 + NH4PF6 → [(η5-C5H5)2Rh]PF6 + 2 HCl + NH4Cl + x H2O
Hexafluorofosforečnan tetrakis(acetonitril)měďný se připravuje přidáním kyseliny hexafluorofosforečné do suspenze oxidu měďného v acetonitrilu.[13]
- Cu2O + 2 HPF6 + 8 CH3CN → 2 [Cu(CH3CN)4]PF6 + H2O
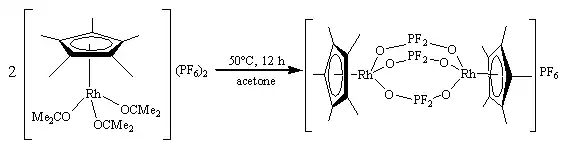
Solvolýza komplexů
Hexafluorfosforečnanový anion je většinou stabilní a tak je vhodným protiiontem, avšak pomocí vysoce elektrofilních kovových center lze indukovat jeho solvolýzu. Příkladem je komplex [(η5-C5Me5)Rh(Me2CO)3](PF6)2, který se rozkládá při zahřívání v acetonu za vzniku difluorfosforečnanového komplexu [(η5-C5Me5)Rh(μ-OPF2O)3Rh(η5-C5Me5)]PF6.[14][15]
Využití
V praxi se obvykle využívá jedné z následujících vlastností hexafluorfosforečnanového aniontu: jde o nekoordinující anion, jeho sloučeniny jsou rozpustné v organických rozpouštědlech, obzvláště polárních, ale nerozpustné ve vodě a je velmi odolný vůči zásadité i kyselé hydrolýze.
Lithium-iontové akumulátory
Lithná sůl hexafluorfosforečnanového aniontu, hexafluorofosforečnan lithný, se používá v lithium-iontových akumulátorech, kde se využívá její dobré rozpustnosti v organických rozpouštědlech a odolnosti vůči redukci na katodě z alkalického kovu.[16] Protože jsou lithné ionty v těchto akumulátorech přítomny převážně v komplexech s elektrolytem,[17] tak je i zde vhodné, že u hexafluorfosforečnanu jde o nekoordinující anion.
Iontové kapaliny
Bylo připraveno několik iontových kapalin kapalných při pokojové teplotě, jako je například 1-butyl-3-methylimidazoliumhexafluorfosfát (zkráceně bmimPF6).[18] K výhodám použití nekoordinujících aniontů oproti koordinujícím patří větší odolnost vůči vysokým teplotám. 1-Butyl-3-methylimidazoliumhexafluorfosfát se rozkládá na N-methylimidazol a 1-chlorbutan nebo na N-butylimidazol a chlormethan; u bmimPF6 k takovým rozkladům nedochází, byl však popsán tepelný rozklad za vzniku fluorovodíku.[10]
Reference
V tomto článku byl použit překlad textu z článku Hexafluorophosphate na anglické Wikipedii.
- J. A. Davies. Synthetic Coordination Chemistry: Principles and Practice. [s.l.]: World Scientific, 1996. ISBN 981-02-2084-7. S. 165.
- S. Constant; J. Lacour. New Trends in Hexacoordinated Phosphorus Chemistry. Příprava vydání J.-P. Majoral. [s.l.]: Springer, 2005. ISBN 3-540-22498-X. S. 3.
- M. M. Woyski. Hexafluorophosphates of Sodium, Ammonium, and Potassium. Inorganic Syntheses. 1950, s. 111–117. DOI 10.1002/9780470132340.ch29.
- A. Molnar; G. K. Surya Prakash; J. Sommer. Superacid Chemistry. [s.l.]: Wiley-Interscience, 2009. Dostupné online. ISBN 0-471-59668-X. S. 44.
- H. E. Affsprung; V. S. Archer. Determination of Hexafluorophosphate by Amperometric Titration with Tetraphenylarsonium Chloride. Analytical Chemistry. 1963, s. 976–978. DOI 10.1021/ac60201a017.
- H. E. Affsprung; V. S. Archer. Gravimetric Determination of Hexafluorophosphate as Tetraphenylarsonium Hexafluorophosphate. Analytical Chemistry. 1963, s. 1912–1913. DOI 10.1021/ac60205a036.
- V. S. Archer; F. G. Doolittle. Spectrophotometric Determination of Hexafluorophosphate with Ferroin. Analytical Chemistry. 1967, s. 371–373. DOI 10.1021/ac60247a035.
- I. G. Ryss; V. B. Tulchinskii. Kinetika Gidroliza Iona Geksaftorofosfata PF -
6 . Zh. Neorg. Khim.. 1964, s. 836–840. - A. E. Gebala; M. M. Jones. The Acid Catalyzed Hydrolysis of Hexafluorophosphate. Journal of Inorganic and Nuclear Chemistry. 1969, s. 771–776. DOI 10.1016/0022-1902(69)80024-2.
- P. J. Dyson. Metal Catalysed Reactions in Ionic Liquids. [s.l.]: Springer Science & Business, 2005. Dostupné online. ISBN 1-4020-3914-X. S. 27.
- H. G. Mayfield; W. E. Bull. Co-ordinating Tendencies of the Hexafluorophosphate Ion. Journal of the Chemical Society A. 1971, s. 2279–2281. DOI 10.1039/J19710002279.
- D. R. Baghurst; D. Michael P. Mingos; M. J. Watson. Application of Microwave Dielectric Loss Heating Effects for the Rapid and Convenient Synthesis of Organometallic Compounds. Journal of Organometallic Chemistry. 1989, s. C43–C45. DOI 10.1016/0022-328X(89)85418-X.
- G. J. Kubas. Tetrakis(acetonitirile)copper(I) Hexaflurorophosphate. Inorganic Syntheses. 1979, s. 90–91. DOI 10.1002/9780470132593.ch15.
- S. J. Thompson; P. M. Bailey; C. White; P. M. Maitlis. Solvolysis of the Hexafluorophosphate Ion and the Structure of [Tris(μ-difluorophosphato)bis(penta-methylcyclopentadienylrhodium)] Hexafluorophosphate. Angewandte Chemie International Edition. 1976, s. 490–491. DOI 10.1002/anie.197604901.
- C. White; S. J. Thompson; P. M. Maitlis. Pentamethylcyclopentadienyl-rhodium and -iridium Complexes XIV. The Solvolysis of Coordinated Acetone Solvent Species to Tris(μ-difluorophosphato)bis[η5-pentamethylcyclopentadienylrhodium(III)] Hexafluorophosphate, to the η5-(2,4-dimethyl-1-oxapenta-1,3-dienyl)(pentamethylcyclopentadienyl)iridium Cation, or to the η5-(2-hydroxy-4-methylpentadienyl)(η5-pentamethylcyclopentadienyl)iridium Cation. Journal of Organometallic Chemistry. 1977, s. 319–325. DOI 10.1016/S0022-328X(00)93278-9.
- J. B. Goodenough; Y. Kim. Challenges for Rechargeable Li Batteries. Chemistry of Materials. 2010, s. 587–603. DOI 10.1021/cm901452z.
- National Power Corp Lithium Ion Batteries [online]. Tektronix Inc., 2004-05-07 [cit. 2010-06-11]. Dostupné v archivu pořízeném z originálu dne 2011-10-26.
- C. M. Gordon; John D. Holbrey; Alan R. Kennedy; Kenneth R. Seddon. Ionic liquid crystals: hexafluorophosphate salts. Journal of Materials Chemistry. 1998, s. 2627–2636. DOI 10.1039/a806169f.
Externí odkazy
 Obrázky, zvuky či videa k tématu Hexafluorfosforečnany na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexafluorfosforečnany na Wikimedia Commons
