Chlorid fosforečný
Chlorid fosforečný je chemická sloučenina se vzorcem PCl5. Je to jeden z nejdůležitějších chloridů fosforu, mezi další patří chlorid fosforitý PCl3 a oxidochlorid fosforečný POCl3. PCl5 nachází využití hlavně jako chlorační činidlo. Jedná se o bezbarvou pevnou látku, komerční produkty však bývají nažloutlé, protože jsou kontaminovány chlorovodíkem.
| Chlorid fosforečný | |
|---|---|

Dvojrozměrný model molekuly chloridu fosforečného | |
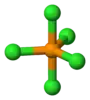
Trojrozměrný model molekuly chloridu fosforečného | |
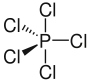
Strukturní vzorec molekuly chloridu fosforečného | |
| Obecné | |
| Systematický název | Chlorid fosforečný |
| Anglický název | Phosphorus pentachloride |
| Německý název | Phosphorpentachlorid |
| Sumární vzorec | PCl5 |
| Vzhled | Žlutobílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 10026-13-8 |
| EC-no (EINECS/ELINCS/NLP) | 233-060-3 |
| Indexové číslo | 015-008-00-X |
| Číslo RTECS | TB6125000 |
| Vlastnosti | |
| Molární hmotnost | 208,239 g/mol |
| Teplota tání | 166,8 °C (za vyššího tlaku) |
| Teplota sublimace | 162 °C |
| Hustota | 2,114 g/cm3 (25 °C) 0,004 65 g/cm3 (296 °C, plyn) |
| Kritická teplota Tk | 372 °C |
| Rozpustnost ve vodě | Rozklad |
| Rozpustnost v nepolárních rozpouštědlech |
Tetrachlormethan Sirouhlík |
| Relativní permitivita εr | 4,23 (23 °C) 2,85 (160 °C) |
| Měrná magnetická susceptibilita | −5,64×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | čtverečná |
| Hrana krystalové mřížky | a= 922 pm c= 744 pm |
| Koordinační geometrie | trigonální bipyramida (D3h) |
| Tvar molekuly | trigonální bipyramida |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −398,9 kJ/mol (plyn) −463,5 kJ/mol (kapalina) |
| Entalpie sublimace ΔHsub | 303,5 J/g |
| Standardní molární entropie S° | 352,8 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −324,7 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H330 H302 H373 H314 EUH014 EUH029 |
| R-věty | R14, R22, R26, R34, R48/20 |
| S-věty | S1/2, S7/8, S26, S36/37/39, S45 |
| NFPA 704 |  0
3
2
|
| Teplota vznícení | Nehořlavý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Fyzikálně-chemické vlastnosti
Chlorid fosforečný je rozpustný v nepolárních rozpouštědlech. Je dobře rozpustný v tetrachlormethanu (CCl4), sirouhlíku (CS2) a kapalných aromatických uhlovodících. S vodou prudce reaguje.
Příprava
PCl5 se připravuje chlorací chloridu fosforitého. Tato reakce byla v roce 2000 použita k výrobě cca 10 000 tun chloridu fosforečného.[2]
- PCl3 + Cl2
 PCl5 ΔH = −124 kJ/mol
PCl5 ΔH = −124 kJ/mol
PCl5 existuje v rovnováze s PCl3 a chlorem a při 180 °C je stupeň disociace cca 40 %[2]. Kvůli této rovnováze vzorky PCl5 často obsahují chlor, který způsobuje nazelenalé zbarvení.
Bezpečnost
Chlorid fosforečný je nebezpečná látka, protože bouřlivě reaguje s vodou. Při reakci vzniká chlorovodík a chlor.
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Reference
V tomto článku byl použit překlad textu z článku Phosphorus pentachloride na anglické Wikipedii.
- Phosphorus pentachloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid fosforečný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid fosforečný na Wikimedia Commons - (anglicky) The period 3 chlorides
- (anglicky) International Chemical Safety Card 0544



