Fluorid sírový
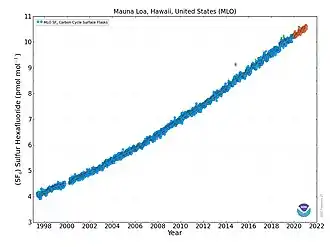
Fluorid sírový (též hexafluorid síry, někdy označovaný podle vzorce SF6) je bezbarvá, plynná, anorganická chemická látka se vzorcem SF6. Tato látka je nepolární a má vysokou hustotu, asi 6krát vyšší, než je hustota vzduchu. Na rozdíl od ostatních fluoridů síry není jedovatý, proto se používá při různých fyzikálních pokusech. Podle IPCC to je skleníkový plyn. Za posledních 16 let se koncentrace fluoridu sírového v ovzduší téměř zdvojnásobila (viz graf).
| Fluorid sírový | |
|---|---|
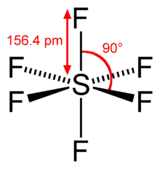
Vzorec | |

3D model | |
| Obecné | |
| Systematický název | Fluorid sírový, hexafluorid síry |
| Ostatní názvy | hexafluor-λ6-sulfan |
| Anglický název | sulfur hexafluoride |
| Sumární vzorec | SF6 |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 2551-62-4 |
| Číslo RTECS | VZ4725000 |
| Vlastnosti | |
| Molární hmotnost | 146,06 g/mol |
| Teplota varu | sublimace: −64 °C; 209 K |
| Hustota | 6,63 kg/m3 |
| Struktura | |
| Krystalová struktura | Kosočtverečná |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | Žádné |
| S-věty | S38 |
| NFPA 704 |  0
0
0
|
| Teplota vznícení | Není vznětlivý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Roku 1901 Henri Moissan a Paul Lebeau objevili, že fluorid sírový vzniká, společně s fluoridem siřičitým (SF4) a dekafluoridem disíry (S2F10), reakcí síry a fluoru (avšak je kontaminován ostatními fluoridy a fluorem, dále probíhá čištění).
- S8 + 24F2 → 8SF6
Dále je potřeba odstranit ostatní produkty, které jsou jedovaté. Zahříváním se rozpadne dekafluorid disíry, a fluorid siřičitý se odstraňuje reakcí s hydroxidem sodným (NaOH), kde vznikají fluorid sodný (NaF) a síran sodný (Na2SO4).
- S2F10 → SF4 + SF6
- SF4 + 6NaOH → Na2SO3 + 4NaF + 3H2O
- 2F2 + 4NaOH → 4NaF + 2H2O + O2
Fluorid sírový je inertní, nereaguje dokonce ani s roztaveným sodíkem, ale je schopen exotermně reagovat s lithiem. Ročně se vyrobí asi 8 000 tun této látky. Asi 70 % se využije v elektrotechnickém průmyslu jako dielektrikum (izolant), dále se využívá při odlévání reaktivních kovů, např. hořčíku, a na plynnou výplň oken.
Změna hlasu
Fluorid sírový je schopen při vdechnutí měnit hlas. Helium má nízkou molární hmotnost, asi 4 g/mol, což je nižší než vzduch, který má hmotnost (výpočtem) asi 30 g/mol, tedy i nižší hustotu. Hélium tedy zvyšuje frekvenci hlasu. Naopak fluorid sírový, který má molární hmotnost asi 146 g/mol, několikanásobně snižuje frekvenci hlasu, tedy vytváří hlubší hlas. Hluboký hlas zůstane po mnohem delší dobu než vysoký hlas u hélia, jelikož tento těžký plyn se z plic špatně dostává pryč, na rozdíl od helia, které je lehčí než vzduch. Rychlost zvuku ve fluoridu sírovém je asi 2,3krát nižší než ve vzduchu.
Reference
- Sulfur hexafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)

