Fluorovodík
Fluorovodík, systematicky fluoran, je za normální teploty bezbarvý, jedovatý plyn. Vzniká přímým slučováním vodíku s fluorem:
- H2 + F2 → 2HF
| Fluorovodík | |
|---|---|
 | |
 | |
 | |
| Obecné | |
| Systematický název | Fluoran |
| Triviální název | Fluorovodík |
| Anglický název | Hydrogen fluoride |
| Německý název | Fluorwasserstoff |
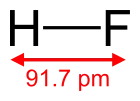
| Sumární vzorec | HF |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7664-39-3 |
| EC-no (EINECS/ELINCS/NLP) | 231-634-8 |
| Indexové číslo | 009-002-00-6 |
| Vlastnosti | |
| Molární hmotnost | 20,006 g/mol |
| Teplota tání | −83,01 °C |
| Teplota varu | 19,54 °C |
| Hustota | 1,749 g/cm3(−191 °C) 1,653 g/cm3 (−94 °C) 0,991 g/cm3 (19,54 °C) |
| Dynamický viskozitní koeficient | 0,53 cP (0 °C) |
| Index lomu | 1,9 (20 °C) |
| Kritická teplota Tk | 188 °C |
| Kritický tlak pk | 6 488 kPa |
| Kritická hustota | 0,29 g/cm3 |
| Relativní permitivita εr | 175 (−73 °C) 134 (−42 °C) 111 (−27 °C) 84 (−1 °C) |
| Tlak páry | 209 kPa |
| Součinitel elektrického odporu | 0,000 16 K−1 |
| Měrná magnetická susceptibilita | 83,6×10−6 cm3 g−1 (0 °C) |
| Ionizační energie | 15,77 eV |
| Povrchové napětí | 10,1 mN/m (0 °C) |
| Struktura | |
| Krystalová struktura | Kosočtverečná (pevná látka) |
| Hrana krystalové mřížky | a= 342 pm b= 432 pm c= 541 pm |
| Tvar molekuly | Rovinný |
| Dipólový moment | 6,37×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −269,8 kJ/mol |
| Entalpie tání ΔHt | 196,4 J/g |
| Entalpie varu ΔHv | 374,4 J/g |
| Entalpie rozpouštění ΔHrozp | 3 039 J/g |
| Standardní molární entropie S° | 173,7 J K−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −271,8 kJ/mol |
| Izobarické měrné teplo cp | 2,4 JK−1g−1 (0 °C) 1,456 JK−1g−1 (25 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H330 H310 H300 H314 |
| R-věty | R26/27/28, R35 |
| S-věty | S1/2, S7/9, S26, S36/37/39, S45 |
| NFPA 704 |  0
4
2
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
za vývoje tepla (exotermní reakce). Průmyslově se vyrábí rozkladem minerálu fluoritu (kazivce) (fluoridu vápenatého) kyselinou sírovou za vysoké teploty (okolo 250 °C):
- CaF2 + H2SO4 → CaSO4 + 2HF.
Snadno se rozpouští ve vodě na bezbarvý, silně žíravý roztok kyseliny fluorovodíkové. Fluorovodík je silně žíravý a při styku s kůží nebo sliznicemi působí velmi bolestivé a špatně se hojící rány. Leptá sklo.
Použití
Fluorovodík se používá při výrobě hliníku a uranu a v organické syntéze zejména při výrobě polymerů (například teflonu) a chladicích směsí freonů.
Reference
- Hydrofluoric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

