Benzén
Benzén je číra bezfarebná, stála kvapalina nemiesiteľná s vodou s charakteristickou sladkastou vôňou. Má sumárny vzorec C6H6, často používaná skratka je Ph-H. Patrí do skupiny aromatických zlúčenín a jej najjednoduchším benzenoidným uhľovodíkom. Benzén patrí medzi najvýznamnejšie suroviny chemického priemyslu. Jeho najvýznamnejším výrobcom je petrochémia. Ako čistú látku ho izoloval fyzik Michael Faraday.
| Benzén | |||||||||||||||
 Benzén | |||||||||||||||
 Benzén | |||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||
| Sumárny vzorec | C6H6 | ||||||||||||||
| Vzhľad | bezfarebná kvapalina | ||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||
| Molárna hmotnosť | 78,116 g·mol-1 | ||||||||||||||
| Teplota topenia | 5,53 °C | ||||||||||||||
| Teplota varu | 80,1 °C | ||||||||||||||
| Hustota | 0,8765 g·cm-3 | ||||||||||||||
| |||||||||||||||
| Ďalšie informácie | |||||||||||||||
| Číslo CAS | 71-43-2 | ||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||
História
Benzén bol objavený v roku 1825 fyzikom M. Faradayom v koksárenskom plyne. Po jeho objave sa dlho viedli spory o jeho chemickej štruktúre. Syntézu benzénu zvládol ako prvý nemecký chemik Eilhard Mitscherlich zahrievaním kyseliny benzoovej s oxidom vápenatým.
Štruktúra

Štruktúra benzénu je jedným z jeho najzaujímavejších aspektov. Sumárny vzorec benzénu C6H6 bol známy už dávno, ale žiaden z mnohých navrhovaných štruktúrnych vzorcov nevystihoval jeho fyzikálno-chemické vlastnosti. Až nemecký chemik Friedrich August Kekulé von Stradonitz navrhol v roku 1865 štruktúru, ktorá v tej dobe najlepšie vystihovala vlastnosti benzénu.
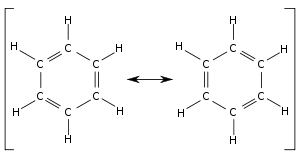
Dnes vieme, že ani Kekulé nevystihol štruktúru benzénu úplne. Presný popis štruktúry molekuly benzénu umožnilo až poznanie delokalizácie elektrónov v planárnych molekulách, akou je aj benzén. Dnes uznávanou štruktúrou benzénu je tvz. rezonančná, ktorá leží medzi dvomi extrémnymi stavmi:
Vlastnosti
Fyzikálne vlastnosti
Benzén je cyklický aromatický uhľovodík. Je za normálnych podmienok kvapalina sladkastej vône s teplotou topenia 5,5 °C, teplotou varu 80,1 °C a hustotou približne 879 kg/m³. Vo vode sa rozpúšťa len veľmi slabo, ale v pomere 8,83 ku 91,17 hm% s ňou vytvára azeotrop. Je rozpustný v organických rozpúšťadlách. Patrí medzi horľaviny I. triedy.
- Mólová hmotnosť: 78,11 g/mol
- Viskozita: 0,65 cP
- Dipólový moment: 0 D
- Teplota vznietenia: 561 °C
Chemické vlastnosti
Benzén poskytuje mnohé reakcie, ktoré sú aj priemyselne využívané. Vzhľadom na vysokú elektrónovú hustotu v uhlíkovom cykle je benzén reaktívny voči elektrofilom. Ale narušenie -systému by viedlo k veľkému nárastu energie, takže po naviazaní elektrofilu sa iný elektrofil musí odšiepiť, aby sa systém obnovil. Takže pre benzén sú charakteristické elektrofilné substitučné (SE) reakcie. Všeobecne možno priebeh SE reakcií na benzéne zapísať nasledovne:
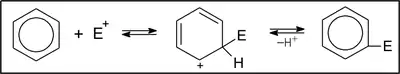
Príkladom SE reakcií na benzénovom jadre je halogenácia (E = Cl, Br); nitrácia (E = NO2); sulfonácia (E = SO3H); alkylácia (E = R).
Príklad elektrofilnej substitučnej reakcie (nitrácia):
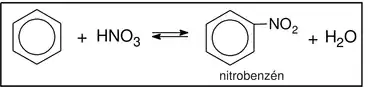
Väčšina elektrofilných substitúcií môže na benzéne prebiehať aj do tretieho a vyššieho stupňa.
Delokalizovaný -systém je veľmi stabilný takže k jeho narušeniu treba použiť pomerne brutálne podmienky:
- Katalytická hydrogenácia pri vyššej teplote na cyklohexán.
- Oxidácia silnými oxidačnými činidlami – chlórom pri zvýšenej teplote na HCH, kyslíkom na maleínanhydrid.
Toxicita
Benzén je podobne ako väčšina ostatných benzenoidných uhľovodíkov jedovatý. Akútna otrava nastáva pri koncentrácii 10 mg/l vzduchu. Medzi prejavy akútnej otravy benzénom patria závrate, zvracanie, tremor, prípadne až bezvedomie. Pri požití extrémne vysokých, hoci aj jednorazových dávok benzénu môže nastať smrť.
Pri chronickej otrave dochádza ku masívnemu poškodeniu obličiek, pečene a kostnej drene – vzniká porucha krvotvorby (rapídne klesá produkcia červených krviniek). Benzén zaraďujeme medzi karcinogény – spôsobuje najmä leukémiu.
Benzén sa v tele detoxifikuje oxidáciou pomocou cytochrómu P-450 v konečnom dôsledku na fenol, ktorý sa vylúči v moči, alebo zoxiduje na vo vode ešte lepšie rozpustné látky. Mutagenitu benzénu spôsobujú okrem iného medziprodukty oxidácií, veľmi reaktívne radikály, ktoré alkylujú membrány, nukleové kyseliny a iné bunkové štruktúry.
Výroba
V histórii bola jediným zdrojom aromatických zlúčenín destilácia uhoľného dechtu, ktorá poskytovala vo veľkých množstvách hlavne benzén, dnes však takouto cestou vzniká len okolo 5% benzénu.
Hlavným zdrojom sú dnes petrochemické procesy a to konkrétne:
- Pyrolýza
- Katalytické reformovanie benzínov
- Disproporciácia toluénu
- Dealkylácia aromátov
Význam pyrolýzy pre získavanie benzénu je značný hlavne v Európe, kde sa pyrolyzujú vyššie uhľovodíky, ktoré sú po štiepení a cyklizácii schopné poskytnúť benzén ako vedľajší produkt. Dnes sa takto v Západnej Európe vyprodukuje až do 60 % benzénu. Primárnym cieľom reformovania je práve produkcia aromátov, na zvýšenie oktánového čísla benzínov. Vyššie frakcie z pyrolyzátu a reformátu vrú veľmi blízko seba, takže sa nedajú separovať destiláciou. Preto sa využíva extrakcia a extraktívna destilácia s polárnym rozpúšťadlom ako sú etylénglykoly, DMSO, alebo sulfolán. Využíva sa tu fakt, že -systém vnáša do molekúl istú polaritu a väčšiu ochotu rozpustiť sa v hydrofilných rozpúšťadlách ako je tomu u alkánov. Takto sa získava takzvaná frakcia BTX (benzén, toluén, xylén), odkiaľ sa benzén oddestiluje.
Disproporciácia a dealkylácia slúžia na premenu menej obchodne atraktívnych derivátov (ako napr. toluénu) na benzén ktorý je žiadanejší. Pri disproporciácii navyše vzniká zmes xylénov, ktoré sú tiež žiadaným artiklom. Pri dealkylácii vznikajú nižšie uhľovodíky, ktoré slúžia ako palivo pre pece rafinérie.
Využitie
Benzén patrí medzi základné suroviny chemického priemyslu. Používa sa v značnom množstve ako rozpúšťadlo. Vyrába sa z neho vo veľkej miere etylbenzén, na výrobu styrénu (monomér polystyrénu), kumén na výrobu fenolov a acetónu, cyklohexán (hydrogenáciou) na výrobu nylonu a silonu, nitrobenzén ako medziprodukt výroby anilínu. V menšej miere sa benzén využíva na výrobu maleínanhydridu a vyšších alkylátov – LAB (lineárnych alkylbenzénov) na výrobu tenzidov.
V laboratórnej praxi slúžil benzén často ako rozpúšťadlo, s mierne väčšou polaritou ako majú alkány (hexán). Dnes sa toho však kvôli jeho karcinogenite opúšťa a nahradzuje sa toluénom, ktorý je relatívne netoxický. Problém je v tom, že toluén má vyššiu teplotu varu a ťažšie sa odstraňuje z reakčných zmesí. Používa sa na azeotropické odstraňovanie vody pri reakciách – pridá sa do reakčnej zmesi a vzniknutá voda oddestiluje s ním v azeotrope, aj tu sa však nahrádza toluénom. Slúži na výrobu alkylátov/acylbenzénov pomocou Friedel-Craftsovej reakcie.
Benzén ako palivo
V medzivojnovom období sa ako palivo používala zmes etanolu a benzénu tzv. dynalkol napríklad pre motorové vozne ČSD. V súčasnosti sa z ekologických dôvodov znižuje obsah aromatických uhľovodíkov v palivách. Čistý benzén sa používa ako prísada do benzínu na zvýšenie oktánového čísla, jeho maximálny podiel je do 1 %. V tabuľke sú uvedené základné hodnoty pre benzén.
| Parameter | jednotka | hodnota |
|---|---|---|
| hmotnostný podiel uhlíka | kg.kg−1 | 92,3 % |
| hmotnostný podiel vodíka | kg.kg−1 | 7,7 % |
| teoreticky potrebné množstvo vzduchu | m3.kg−1 | 11,35 |
| dolná výhrevnosť | kJ.kg−1 | 40405 |
| výhrevnosť stechiometrickej zmesi so vzduchom | kJ.m−3 | 3538 |

