Sfingolipidy
Sfingolipidy jsou třída lipidů, které obsahují základní skelet sfingoidních bází, tj. sadu alifatických amino alkoholů, která zahrnuje sfingosin. Sfingolipidy byly objeveny v extraktech mozku v 70. letech devatenáctého století a kvůli jejich neznámé povaze byly nazvány podle mytologické sfingy.[1] Tyto sloučeniny hrají důležitou úlohu v signální transdukci a rozpoznávání buněk. Sfingolipidózy, tj. poruchy metabolismu sfingolipidů, mají zvláštní vliv na nervovou tkáň. Sfingolipid s R skupinou sestávající pouze z atomu vodíku je ceramid. Jiné běžné R skupiny zahrnují fosfocholin, poskytující sfingomyelin, a různé monomery nebo dimery cukru, z nichž se získávají cerebrosidy a globosidy. Cerebrosidy a globosidy jsou známé pod společným názvem glykosfingolipidy.
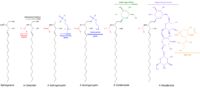
Struktura
Báze s dlouhým řetězcem, známé také jako sfingoidní báze, jsou prvními přechodnými produkty syntézy de novo sfingolipidu u kvasinek i savců. Tyto sloučeniny, specificky známé jako fytosfingosin a dihydrosfingosin (také známý jako sfinganin,[2] ačkoli tento termín je méně častý), jsou hlavně sloučeniny C18, s poněkud nižšími hladinami C20 bází.[3] Keramidy a glykosfingolipidy jsou N- acylové deriváty těchto sloučenin.[4]
Sphingosinový řetězec je O-vázán na (obvykle) nabitou nadskupinu, jako je ethanolamin, serin nebo cholin. Páteř je také amidově vázán na acylovou skupinu, např. mastná kyselina.
Typy
Jednoduché sfingolipidy, které zahrnují sfingoidní báze a keramidy, vytvářejí časné produkty syntetických dráh sfingolipidu.
- Sfingoidní báze jsou základní stavební kameny všech sfingolipidů. Hlavními savčími sfingoidovými bázemi jsou dihydrosphingosin a sfingosin, zatímco dihydrosfingosin a fytosfingosin jsou principiální sfingoidní báze v kvasinkách.[5][6] Sfingosin, dihydrosphingosin a fytosfingosin mohou být fosforylovány.
- Ceramidy jsou N- acylované sphingoidní báze bez dalších funkčních skupin.
- Dihydroceramid se vyrábí N- acylací dihydrosphingosinu. Dihydroceramid se nachází v kvasnicových i savčích systémech.
- Ceramid se vyrábí u savců desaturací dihydroceramidu pomocí dihydroceramid desaturázy 1 (DES1). Tato vysoce bioaktivní molekula může být také fosforylována za vzniku ceramid-1-fosfátu.
- Phytoceramid se produkuje v kvasinkách hydroxylací dihydroeramidu na C-4.
Komplexní sfingolipidy mohou být tvořeny přidáním funkční skupiny k ceramidu nebo fytoceramidu:
- Sphingomyeliny mají molekulu fosfocholinu nebo fosfoethanolaminu s esterovou vazbou na 1-hydroxyskupinu ceramidu.
- Glykosfingolipidy jsou ceramidy s jedním nebo více zbytky cukru spojenými v β- glykosidické vazbě v poloze 1-hydroxyskupiny (viz obrázek).
- Ceramidy obsahující inositol, které jsou odvozeny z fytoeramidu, se produkují v kvasnicích. Patří mezi ně inositol fosforylceramid, manózový inositol fosforylceramid a manozový diinositolfosforylceramid.
Metabolismus sfingolipidu u savců
De novo syntéza sfingolipidu začíná tvorbou 3-keto-dihydrosphingosinu serinpalmitoyltransferázou.[7] Výhodnými substráty pro tuto reakci jsou palmitoyl-CoA a serin. Studie však ukázaly, že serinpalmitoyltransferáza má i určitou aktivitu vůči jiným druhům mastných acyl-CoA[8] a alternativních aminokyselin[9] a rozmanitost sfingoidních bází byla nedávno přezkoumána.[10] Dále se 3-keto-dihydrosfingosin redukuje za vzniku dihydrosphingosinu. Dihydrosphingosin se acyluje (dihydro) -ceramid syntázou, jako je Lass1p nebo Lass2p (také známkou jako CerS), za vzniku dihydroceramidu.[11] To je nesaturovaná foerma ceramidu.[12]

Ceramid může následně mít několik osudů. Může být fosforylován ceramid kinázou za vzniku ceramid-1-fosfátu. Alternativně může být glykosylován glukosylceramid syntázou nebo galaktosylceramid syntázou. Dále může být přeměněn na sfingomyelin přidáním fosforylcholinové skupiny sfingomyelin syntázou. Diacylglycerole je následně generován tímto procesem. Nakonec může být ceramid rozdělen na ceramidázu za vzniku sfingosinu. Sfingosin může být fosforylován za vzniku sfingosin-1-fosfátu. To může být defosforylováno k obnovení sfingosinu.[13]
Způsoby rozpadu umožňují reverze těchto metabolitů na ceramid. Komplexní glykosfingolipidy se hydrolyzují na glukosylceramid a galaktosylceramid. Tyto lipidy jsou pak hydrolyzovány beta-glukosidasami a beta-galaktosidasami k regeneraci ceramidu. Podobně může být sfingomyelin rozdělen sfingomyelinázou za vzniku ceramidu. Jedinou cestou, kterou jsou sfingolipidy přeměněny na nesfingolipidy, je přes sfingosin-1-fosfát-lyasu. To vytváří ethanolamin fosfát a hexadecenal.[14]
Funkce sfingolipidů u savců
Sphingolipidy chrání povrch buněk před škodlivými faktory prostředí tím, že vytvoří mechanicky stabilní a chemicky odolný vnější vrstvu lipidové dvojvrstvy plazmatické membrány. Bylo zjištěno, že některé komplexní glykosfingolipidy se podílejí na specifických funkcích, jako je rozpoznávání buněk a signalizace. Rozpoznání buněk závisí hlavně na fyzikálních vlastnostech sfingolipidů, zatímco signalizace zahrnuje specifické interakce glykanových struktur glykosfingolipidů s podobnými lipidy přítomnými v sousedních buňkách nebo s proteiny. Nedávno se ukázalo, že jednoduché metabolity sfingolipidu, jako je ceramid a sfingosin-1-fosfát, jsou důležitými mediátory v signalizačních kaskádách, které se účastní apoptózy, proliferace, stresových reakcí, nekrózy, zánětu, autofagie, senescence a diferenciace.[15][16][17][18][19][20] Lipidy na bázi ceramidu se samovolně agregují v buněčných membránách a tvoří oddělené fáze méně tekuté než objemné fosfolipidy. Tyto mikrodomény na bázi sfingolipidu nebo " lipidové rafty " byly původně navrženy pro třídění membránových proteinů po buněčných cestách membránového transportu. V současné době se většina výzkumů zaměřuje na organizační funkci během přenosu signálu.[21]
Sphingolipidy jsou syntetizovány cestou, která začíná v ER a je dokončena v Golgiho aparátu, ale tyto lipidy jsou obohaceny v plazmatické membráně av endosomech, kde plní mnoho z jejich funkcí.[22] Transport probíhá přes vezikuly a monomerní transport v cytosolu. Sphingolipidy prakticky chybí mitochondrie a ER, ale tvoří 20-35 molární frakce plazmatických membránových lipidů.[23]
U experimentálních zvířat podávání sfingolipidů inhibuje karcinogenezi střev, snižuje LDL cholesterol a zvyšuje HDL cholesterol.[24]
Kvasinkové sfingolipidy
Kvůli neuvěřitelné složitosti systémů savců se kvasinky často používají jako modelový organismus pro testování nových cest. Tyto jednobuněčné organismy jsou často mnohem genetičtější než savčí buňky a kmenové knihovny jsou k dispozici pro zásobování kmenů, které nesou téměř žádný neletální otevřený čtecí rámec s jediným delením. Dva nejčastěji používané kvasinky jsou Saccharomyces cerevisiae a Schizosaccharomyces pombe, ačkoli výzkum se provádí také v patogenních kvasinkách Candida albicans. Kromě důležité strukturální funkce komplexní sfingolipidy (inositol fosforylceramid a jeho mannosylované deriváty), na sfingoid bázi fytosfingosinu a dihydrosfingosinu (sfinganin) hrají zásadní signální roli u S. cerevisiae. Tyto účinky zahrnují regulaci endocytózy, ubikvitinu závislé proteolýzy (a tím i regulace příjmu živin[25]), cytoskeletálních dynamiky, buněčného cyklu, translaci, posttranslační modifikace proteinu, a reakce tepelného stresu.[26] Dále byla nedávno popsána modulace metabolismu sfingolipidu fosfatidylinositol (4,5) -bisfosfátovou signalizací prostřednictvím Slm1p a Slm2p a kalcineurinu.[5] Dále byla prokázána interakce na úrovni substrátu mezi komplexní syntézou sfingolipidu a cyklováním fosfatidylinositol-4-fosfátu fosfatidylinositol kinázou Stt4p a lipidovou fosfatázou Saclp.[27]
Rostlinné sfingolipidy
Vyšší rostliny obsahují širší škálu sfingolipidů než živočichové a houby.
Poruchy
Existuje několik poruch metabolismu sfingolipidu, známých jako sfingolipidózy. Mezi hlavní členy této skupiny patří choroba Niemann-Pick, Fabryho choroba, Krabbeova choroba, Gaucherová nemoc, Tay-Sachsova choroba a metachromatická leukodystrofie. Obvykle se dědí autosomálně recesivním způsobem, ale Fabryho choroba je spojena s X. Společně mají sphingolipidózy výskyt přibližně 1 z 10 000, ale podstatně více u některých populací, jako jsou Aškenazi židé. Enzymová substituční terapie je k dispozici k léčbě převážně Fabryho choroby a Gaucherovy choroby a lidé s těmito typy sfingolipidóz mohou žít dobře do dospělosti. Ostatní typy jsou obecně smrtelné ve věku 1 až 5 let u dětských forem, ale progrese může být mírná u forem onemocnění mladistvých nebo dospělých. Sfiingolipidy jsou také zahrnuty do proteinu frataxin (Fxn), jehož nedostatek je spojen s Friedreichovou ataxií (FRDA). Ztráta Fxn v nervovém systému u myší také aktivuje dráhu železa / sfingolipidu / PDK1 / Mef2, což naznačuje, že mechanismus je evolučně konzervován. Navíc koncentrace sfingolipidu a aktivity PDK1 jsou také zvýšeny v srdcích pacientů s FRDA, což naznačuje, že podobná cesta je ovlivněna v FRDA.[28] Jiný výzkum ukázal, že akumulace železa v nervových systémech mušek zvyšuje syntézu sfingolipidů, které aktivují 3-fosfoinositidovou protein kinázu-1 (Pdk1) a faktor 2 zvyšující myocyty (Mef2) k vyvolání neurodegenerace dospělých fotoreceptorů.[29]
Galerie
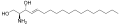 Sfingosin
Sfingosin
Příbuzná témata
- Sfingosylfosfatid
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Sphingolipid na anglické Wikipedii.
- Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis. Clinical Neuropharmacology. 2010, roč. 33, čís. 2, s. 91–101. DOI 10.1097/wnf.0b013e3181cbf825. PMID 20061941. (anglicky)
- Sphingolipid functions in Saccharomyces cerevisiae: comparison to mammals. Annual Review of Biochemistry. 1998, roč. 67, s. 27–48. DOI 10.1146/annurev.biochem.67.1.27. PMID 9759481. (anglicky)
- A brief, very comprehensible review is given in Gunstone, F. (1996) Fatty Acid and Lipid Chemistry, pp 43-44. Blackie Academic and Professional. ISBN 0-7514-0253-2
- Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast. Journal of Lipid Research. May 2008, roč. 49, čís. 5, s. 909–21. DOI 10.1194/jlr.R800003-JLR200. PMID 18296751. (anglicky)
- Bioactive sphingolipids: metabolism and function. Journal of Lipid Research. April 2009, roč. 50 Suppl, s. S91-6. DOI 10.1194/jlr.R800080-JLR200. PMID 19017611. (anglicky)
- Characterization of serine palmitoyltransferase activity in Chinese hamster ovary cells. Biochimica et Biophysica Acta. December 1983, roč. 754, čís. 3, s. 284–91. DOI 10.1016/0005-2760(83)90144-3. PMID 6652105. (anglicky)
- Utilization of different fatty acyl-CoA thioesters by serine palmitoyltransferase from rat brain. Journal of Lipid Research. February 1984, roč. 25, čís. 2, s. 185–8. Dostupné v archivu pořízeném dne 2020-07-22. PMID 6707526. (anglicky) Archivováno 22. 7. 2020 na Wayback Machine
- Ceramide synthase inhibition by fumonisin B1 causes accumulation of 1-deoxysphinganine: a novel category of bioactive 1-deoxysphingoid bases and 1-deoxydihydroceramides biosynthesized by mammalian cell lines and animals. The Journal of Biological Chemistry. February 2009, roč. 284, čís. 8, s. 4786–95. DOI 10.1074/jbc.M808798200. PMID 19095642. (anglicky)
- Biodiversity of sphingoid bases ("sphingosines") and related amino alcohols. Journal of Lipid Research. August 2008, roč. 49, čís. 8, s. 1621–39. DOI 10.1194/jlr.R800012-JLR200. PMID 18499644. (anglicky)
- When do Lasses (longevity assurance genes) become CerS (ceramide synthases)?: Insights into the regulation of ceramide synthesis. The Journal of Biological Chemistry. September 2006, roč. 281, čís. 35, s. 25001–5. Dostupné v archivu pořízeném dne 2020-07-22. DOI 10.1074/jbc.R600010200. PMID 16793762. (anglicky) Archivováno 22. 7. 2020 na Wayback Machine
- Further characterization of rat dihydroceramide desaturase: tissue distribution, subcellular localization, and substrate specificity. Lipids. October 2000, roč. 35, čís. 10, s. 1117–25. DOI 10.1007/s11745-000-0627-6. PMID 11104018. (anglicky)
- Principles of bioactive lipid signalling: lessons from sphingolipids. Nature Reviews Molecular Cell Biology. February 2008, roč. 9, čís. 2, s. 139–50. DOI 10.1038/nrm2329. PMID 18216770. (anglicky)
- Sphingosine-1-phosphate lyase in immunity and cancer: silencing the siren. Trends in Molecular Medicine. May 2007, roč. 13, čís. 5, s. 210–7. DOI 10.1016/j.molmed.2007.03.005. PMID 17416206. (anglicky)
- The Ceramide-centric universe of lipid-mediated cell regulation: stress encounters of the lipid kind. The Journal of Biological Chemistry. July 2002, roč. 277, čís. 29, s. 25847–50. DOI 10.1074/jbc.R200008200. PMID 12011103. (anglicky)
- Sphingosine 1-phosphate, a key cell signaling molecule. The Journal of Biological Chemistry. July 2002, roč. 277, čís. 29, s. 25851–4. DOI 10.1074/jbc.R200007200. PMID 12011102. (anglicky)
- Regulation of autophagy by sphingosine kinase 1 and its role in cell survival during nutrient starvation. The Journal of Biological Chemistry. March 2006, roč. 281, čís. 13, s. 8518–27. Dostupné online. DOI 10.1074/jbc.M506182200. PMID 16415355. (anglicky)
- Role of ceramide in cellular senescence. The Journal of Biological Chemistry. December 1995, roč. 270, čís. 51, s. 30701–8. DOI 10.1074/jbc.270.51.30701. PMID 8530509. (anglicky)
- Caspase-dependent initiation of apoptosis and necrosis by the Fas receptor in lymphoid cells: onset of necrosis is associated with delayed ceramide increase. Journal of Cell Science. December 2002, roč. 115, čís. Pt 23, s. 4671–83. DOI 10.1242/jcs.00153. PMID 12415011. (anglicky)
- Sphingosine kinase: Role in regulation of bioactive sphingolipid mediators in inflammation. Biochimie. June 2010, roč. 92, čís. 6, s. 707–15. DOI 10.1016/j.biochi.2010.02.008. PMID 20156522. (anglicky)
- Structure and function of sphingolipid- and cholesterol-rich membrane rafts. The Journal of Biological Chemistry. June 2000, roč. 275, čís. 23, s. 17221–4. DOI 10.1074/jbc.R000005200. PMID 10770957. (anglicky)
- Intracellular trafficking of sphingolipids: relationship to biosynthesis. Biochimica et Biophysica Acta. December 2006, roč. 1758, čís. 12, s. 1885–92. DOI 10.1016/j.bbamem.2006.08.004. PMID 16996025. (anglicky)
- Sphingolipid transport: rafts and translocators. The Journal of Biological Chemistry. July 2002, roč. 277, čís. 29, s. 25855–8. DOI 10.1074/jbc.R200010200. PMID 12011105. (anglicky)
- Sphingolipids in food and the emerging importance of sphingolipids to nutrition. The Journal of Nutrition. July 1999, roč. 129, čís. 7, s. 1239–50. Dostupné online. PMID 10395583. (anglicky)
- Phytosphingosine as a specific inhibitor of growth and nutrient import in Saccharomyces cerevisiae. The Journal of Biological Chemistry. September 2001, roč. 276, čís. 38, s. 35614–21. DOI 10.1074/jbc.m105653200. PMID 11468289. (anglicky)
- Yeast sphingolipids: recent developments in understanding biosynthesis, regulation, and function. Biochimica et Biophysica Acta. March 2007, roč. 1771, čís. 3, s. 421–31. DOI 10.1016/j.bbalip.2006.08.005. PMID 16997623. (anglicky)
- Modulation of sphingolipid metabolism by the phosphatidylinositol-4-phosphate phosphatase Sac1p through regulation of phosphatidylinositol in Saccharomyces cerevisiae. The Journal of Biological Chemistry. March 2009, roč. 284, čís. 12, s. 7588–96. DOI 10.1074/jbc.M808325200. PMID 19139096. (anglicky)
- Loss of Frataxin activates the iron/sphingolipid/PDK1/Mef2 pathway in mammals. eLife. November 2016, roč. 5. DOI 10.7554/eLife.20732. PMID 27901468. (anglicky)
- Loss of Frataxin induces iron toxicity, sphingolipid synthesis, and Pdk1/Mef2 activation, leading to neurodegeneration. eLife. June 2016, roč. 5. DOI 10.7554/eLife.16043. PMID 27343351. (anglicky)