Translace (biologie)
Translace je sekundární proces syntézy bílkovin (část procesu genové exprese). Jde o sestavení primární struktury bílkoviny podle záznamu v transkripci vytvořené mediátorovou RNA (mRNA). Během translace je informace zapsaná v mRNA podle přesných pravidel genetického kódu dekódována a je podle ní sestaven řetězec aminokyselin. Translaci můžeme rozdělit do tří fází: iniciace, elongace a terminace.
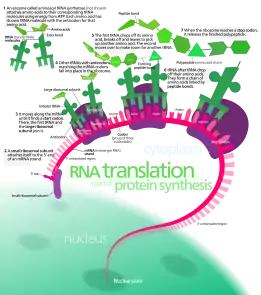
Průběh translace
Proces translace je poměrně konzervovaný napříč všemi základními větvemi života, nicméně názvy faktorů se mírně liší a některé proteiny vznikly dodatečně až u eukaryotických organismů (tzn. organismů s pravým jádrem - zahrnuje živočichy či rostliny).
Iniciace
Během iniciační fáze translace dochází ke kontaktu AUG startkodonu na mRNA s iniciační tRNA nesoucí methionin (tRNAMet). Celý proces koordinují tzv. iniciační faktory, kterých jsou u eukaryot až desítky (u bakterií mají podobnou funkci, ale není jich tolik).
V prvním kroku se na malou ribozomální podjednotku naváže iniciační tRNA a iniciační faktor eIF2 (resp. IF2 u bakterií[1]) ve své aktivní formě s GTP (eIF2-GTP). Výsledný komplex se označuje jako preiniciační komplex. Na 5' guanosinové čepičce mRNA se mezitím u eukaryot naváže helikáza eIF4A, která je schopna rozmotat jakékoliv sekundární struktury přítomné na v 5' konci RNA. Jiné komplexy se podobně asociují s poly(A) koncem této mRNA. Takto připravená mRNA se váže na preiniciační komplex.[2]
V dalším kroku je nutné, aby se malá ribosomální podjednotka dostala na správné místo na mRNA, tj. na start kodon AUG. Toto skenování mRNA se zastaví, jakmile tRNAMet rozpozná start kodon, což je většinou první kodon od 5' konce.[2] Rozpoznání start kodonu AUG od běžných AUG je usnadněno dalšími nukleotidy v jeho okolí - celá sekvence vytváří tzv. sekvenci Kozakové - u obratlovců přibližně RCCAUGG.[3] Po rozpoznání startovního kodonu dojde k hydrolýze GTP na faktoru eIF2. Po hydrolýze GTP dojde k disociaci všech zbývajících faktorů z komplexu a k připojení 60S podjednotky. Zároveň hydrolyzuje GTP v iniciačním faktoru eIF5, což odstartuje proces elongace.[2]
Elongace
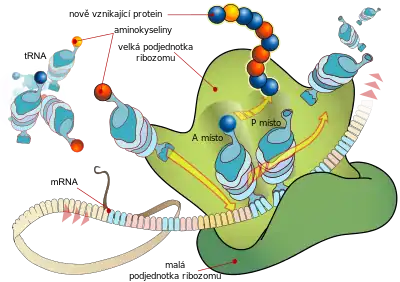
Ribozom je v této fázi kompletní a připravený vytvářet polypeptid postupným přidáváním jedné aminokyseliny za druhou. Přidání každé aminokyseliny probíhá ve čtyřech krocích, při nichž je vždy příslušná aminokyselina přiřazena podle pravidel genetického kódu - ke každé trojici (tripletu) nukleových bazí je přiřazena jedna z dvaceti proteinogenních aminokyselin. Tyto kroky probíhají v dutinách uvnitř ribozomu, a to hlavně na tzv. A-místě a P-místě ribozomu. Opět se účastní i další faktory, zvané tentokrát elongační (EF). Aminokyseliny jsou do ribozomu doručovány v aktivované formě, připojené na příslušnou tRNA pomocí aminoacyl-tRNA syntetázy.
V první fázi přichází aminoacyl-tRNA (tRNA s navázanou aminokyselinou) do A-místa ribozomu. S tímto procesem pomáhá elongační faktor eEF1A (u bakterií EF-Tu). Přinesená aminoacyl-tRNA musí nést právě tu aminokyselinu, která odpovídá kodonu v právě překládané části mRNA. Pokud přinesená aminokyselina neodpovídá, v druhé fázi je hned z ribozomu vypuzena. Pokud kodon na mRNA odpovídá tzv. antikodonu v tRNA, eEF1A hydrolyzuje své GTP a umožňuje přechod do další fáze elongace. V této třetí fázi je vytvořena vazba mezi peptidovým řetězcem, který se nachází v P-místě ribozomu, a aminoskupinou aminokyseliny, která byla přijata do A-místa.[2] Pokud se jedná o samotný počátek elongace, dochází k podobnému jevu, jen v P-místě ještě není peptidový řetězec, nýbrž jen iniciační tRNA s navázaným methioninem - první aminokyselinou každého polypeptidu.
Čtvrtým krokem je translokace, při níž se celý peptidový řetězec a mRNA posune o jedno místo (resp. o jeden triplet bazí) dále směrem do P-místa tak, aby se uvolnil prostor v A-místě pro další aminoacyl-tRNA. Procesu napomáhá elongační faktor eEF2 (u bakterií EF-G), který se vmezeří do A-místa a translokuje tímto způsobem peptidový řetězec dál směrem k východu z ribozomu. Následně je GTP v eEF2 hydrolyzováno, eEF2 odchází z A-místa pryč a může se spustit další kolo elongace, při němž se do A-místa opět navazuje odpovídající aminokyselina.[2]
Terminace
Pokud se posouváním ribozomu do A-místa dostane kodon UAA, UAG nebo UGA, je polypeptid hotový a proteosyntéza končí. Jedná se totiž o terminační kodony, které nesignalizují žádnou aminokyselinu, a tak nemají jiný smysl.[pozn. 1] V takovém případě se vzniklý polypeptid, uspořádaný do primární struktury, uvolní. Procesu napomáhají tzv. release faktory.[2] Pro polypeptid to však není konec, ještě dochází k skládání (foldingu) a k celé řadě posttranslačních úprav proteinů, čímž teprve vzniká zralý protein (bílkovina).
Energetika
Translace je energeticky velice náročná. Odhaduje se, že bakterie E. coli spotřebuje 90 % své celkové potřeby energie právě na syntézu proteinů.[8] Na pouhou jednu aminokyselinu se standardně uvádí spotřeba 4 molekul ATP:[9]
- 2 ATP – aktivace aminokyseliny navázáním aminokyseliny na tRNA
- 2 ATP – vznik peptidové vazby
Ze studií srovnávajících normální energetickou potřebu se spotřebou energie ve stavu, kdy je zablokována syntéza proteinů, vychází poněkud vyšší čísla, konkrétně asi 7,5 ATP na jednu zařazenou aminokyselinu (u ptáků).[10]
V průběhu translačního cyklu se využívají různé elongační faktory (EF-T, EF-G).
Posttranslační úpravy
Po dokončení syntézy polypeptidového řetězce může u řady bílkovin docházet k následným úpravám, tzv. posttranslačním modifikacím. Tyto modifikace vedou k finální podobě nativní bílkoviny a jsou často zcela zásadní pro její funkci. Mezi nejvýznamnější posttranslační modifikace patří částečné proteolytické štěpení, tvorba disulfidových vazeb, glykosylace, γ-karboxylace, hydroxylace, fosforylace, biotinylace či acylace.
Poznámky
- U některých zelených řas, nálevníků a diplomonád se vyvinul nekanonický kód, při kterém UAG a UAA translaci neukončují a namísto toho kódují glutamin, podobně UGA kóduje u některých nálevníků cystein a u rodu Mycoplasma tryptofan.[4][5][6][7] U některých druhů archeí a baktérií je při biosyntéze enzymů pro metabolismus metanu normální Stop-funkce kodonu UAG modifikována přítomností zvláštní genové sekvence mRNA, umožňující navázat pyrolysinovou tRNA a zabudovat do proteinu pyrolysin. Při biosyntéze některých proteinů archeí, baktérií i eukaryot umožňuje podobný mechanismus ignorovat při translaci normální Stop-funkci kodonu UGA, navázat selenocysteinovou tRNA, vzniklou selenizací serinové tRNA, a zabudovat do proteinu selenocystein.
Reference
- Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- POLLARD, Thomas D; EARNSHAW, William C. Cell Biology. 2. vyd. [s.l.]: Saunders, 2007. ISBN 1416022554.
- KOZAK, M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs.. Nucleic Acids Res.. 1987-10-26, roč. 20, čís. 15, s. 8125–48. Dostupné online.
- COCQUYT, Ellen; GILE, Gillian H.; LELIAERT, Frederik, Heroen Verbruggen, Patrick J. Keeling, Olivier De Clerck. Complex phylogenetic distribution of a non-canonical genetic code in green algae. S. 1–24. BMC Evolutionary Biology [online]. 26. říjen 2010 [cit. 2010-10-29]. Svazek 10, čís. 327, s. 1–24. Dostupné online. PDF . ISSN 1471-2148. DOI 10.1186/1471-2148-10-327. (anglicky)
- HOFFMAN, David C.; ANDERSON, Richard C.; DUBOIS, Michelle L., Prescott David M. Macronuclear gene-sized molecules of hypotrichs. Nucleic Acids Research. 25. duben 1995, svazek 23, čís. 8, s. 1279–1283. Dostupné online [pdf]. PMID 7753617. (anglicky)
- SCHNEIDER, Sigrid U.; LEIBLE, Michael B.; Xiao-Ping Yang. Strong homology between the small subunit of ribulose-1,5-bisphosphate carboxylase/oxygenase of two species of Acetabularia and the occurrence of unusual codon usage. Molecular and General Genetics. Únor 2001, svazek 218, čís. 3, s. 445–452. Abstrakt. Dostupné online. DOI 10.1007/BF00332408. PMID 2573818. (anglicky)
- KEELING, Patrick J.; DOOLITTLE, W. Ford. A non-canonical genetic code in an early diverging eukaryotic lineage. The European Molecular Biology Organization Journal. 1. květen 1996, svazek 15, čís. 9, s. 2285–2290. Dostupné online [pdf]. PMID 8641293. (anglicky)
- VODRÁŽKA, Zdeněk. Biochemie. Praha: Academia, 2007. ISBN 978-80-200-0600-4.
- BERG ., Jeremy M; TYMOCZKO, John L; STRYER, Lubert. Biochemistry. 5. vyd. New York: W.H.Freeman, 2002. Dostupné online. ISBN 0-7167-3051-0.
- AOYAGI, Y.; TASAKI, I.; OKUMURA, J., et al. Energy cost of whole-body protein synthesis measured in vivo in chicks. Comp Biochem Physiol A Comp Physiol.. 1988, roč. 91, čís. 4, s. 765–8. Dostupné online. ISSN 0300-9629.