Oxidace alkoholů
Oxidace alkoholů jsou organické redoxní reakce alkoholů, kdy se alkoholová funkční skupina mění na jinou (aldehyd, keton, karboxylovou kyselinu) s atomem uhlíku ve vyšším oxidačním čísle.
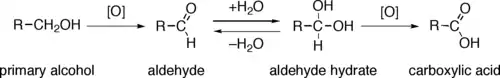
Odštěpení ekvivalentu hydridu přemění primární alkohol na aldehyd a sekundární na keton. Oxidace primárních alkoholů na karboxylové kyseliny obvykle probíhají přes odpovídající aldehydy, které se reakcemi s vodou přeměňují na geminální dioly, R-CH(OH)2. Oxidace primárních alkoholů na aldehydy bez tvorby karboxylových kyselin tak lze dosáhnout nepřítomností vody, bez níž další oxidace neprobíhá.
Oxidace na aldehydy
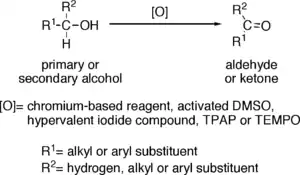
Oxidace alkoholů na aldehydy jsou částečnými oxidacemi, protože jejich produkty lze dále přeměnit na karboxylové kyseliny. Při tvorbě aldehydů je potřeba zahřívání a destilace. Teplota reakční směsi by měla být vyšší než teplota varu aldehydu a nižší než teplota varu alkoholu.
Oxidační činidla vhodná k přeměnám primárních alkoholů na aldehydy se obvykle dají použít i na přípravu ketonů ze sekundárních aldehydů. K použitelným reaktantům patří:
- Činidla obsahující chrom, například Collinsovo činidlo (CrO3·Py2), dichroman pyridinia a chlorchroman pyridinia.
- Sulfoniové sloučeniny označované jako aktivovaný „dimethylsulfoxid“ (DMSO), vzniklá reakcí DMSO s elektrofily, jako je oxalylchlorid (Swernova oxidace), karbodiimid (Pfitznerova–Moffattova oxidace) nebo komplex SO3·Py (Parikhova–Doeringova oxidace).
- Hypervalentní sloučeniny jodu, například Dessův–Martinův perjodinan a kyselina 2-jodoxybenzoová.
- Katalytické množství ruthenistanu tetrapropylamonného za přítomnosti nadbytku N-methylmorfolin-N-oxidu (Leyova oxidace).
- Katalytické množství TEMPO a nadbytek chlornanu sodného (oxidace katalyzovaná oxoamoniem).
- Oxidace dikyslíkem či jiným koncovým oxidantem za katalýzy komplexy přechodných kovů.[1]
Allyl- a benzylalkoholy lze oxidovat za přítomnosti jiných alkoholů pomocí selektivních činidel, jako je oxid manganičitý (MnO2).
Oxidace na ketony
Reaktanty použitelnými na oxidace sekundárních alkoholů, a obvykle neúčinnými u oxidací primárních alkoholů na aldehydy, jsou například oxid chromový (CrO3) ve směsi s kyselinou sírovou a acetonem (Jonesova oxidace) nebo určitými ketony, například cyklohexanonem, za přítomnosti isopropopoxidu hlinitého (Oppenauerova oxidace). Je možné použít i katalýzu oxoamoniem. Za přítomnosti primárních alkoholů je také účinný chlornan sodný.[2]
Oxidace na karboxylové kyseliny
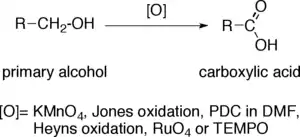
Přímou oxidaci primárních alkoholů na karboxylové kyseliny lze provést těmito činidly či postupy:
- Manganistan draselný (KMnO4);
- Jonesova oxidace;
- Dichroman pyridinia v 2,5-dimethylfuranu;
- Heynsova oxidace;
- Oxid rutheničelý (RuO4);
- TEMPO.
Oxidace diolů
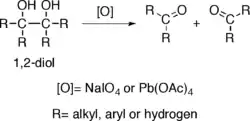
Alkoholy s dvěma hydroxylovými skupinami na sousedních uhlících, nazývané vicinální dioly nebo 1,2-dioly, při oxidacích činidly jako jsou jodistan sodný (NaIO4), (diacetoxyjod)benzen (PhI(OAc)2)[3] nebo octan olovičitý (Pb(OAc)4) štěpí vazby mezi uhlíkovými atomy, na které jsou hydroxyly navázány, což vede ke vzniku dvou karbonylových skupin. Tato reakce se nazývá glykolové štěpení.
Reference
V tomto článku byl použit překlad textu z článku Alcohol oxidation na anglické Wikipedii.
- Camilla Parmeggiani; Francesca Cardona. Transition metal based catalysts in the aerobic oxidation of alcohols. Green Chemistry. 2012-01-03, s. 547–564. Dostupné online. ISSN 1463-9270. DOI 10.1039/C2GC16344F.
- R. Stevens; K. T. Chapman; H. N. Weller. Convenient and inexpensive procedure for oxidation of secondary alcohols to ketones. Journal of Organic Chemistry. 1980, s. 2030–2032. DOI 10.1021/jo01298a066.
- K. C. Nicolaou; V. A. Adsool; C. R. Hale. An expedient procedure for the oxidative cleavage of olefinic bonds with PhI(OAc)2, NMO, and catalytic OsO4. Organic Letters. 2010, s. 1552–1555. DOI 10.1021/ol100290a. PMID 20192259.