Octan olovičitý
Octan olovičitý je organická sloučenina, bezbarvá pevná látka rozpustná v nepolárních rozpouštědlech, nejde tedy o sůl. Působením vzdušné vlhkosti se rozkládá a skladuje se jako roztok v koncentrované kyselině octové.
| Octan olovičitý | |
|---|---|
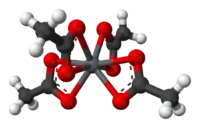
Strukturní vzorec | |
| Obecné | |
| Systematický název | ethanoát olovičitý |
| Funkční vzorec | (CH3COO)4Pb |
| Sumární vzorec | C₈H₁₂O₈Pb |
| Vzhled | světle růžové krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 546-67-8 |
| EC-no (EINECS/ELINCS/NLP) | 208-908-0 |
| PubChem | 11025 |
| SMILES | CC(=O)O[Pb](OC(C)=O)(OC(C)=O)OC(C)=O |
| InChI | 1S/4C2H4O2.Pb/c4*1-2(3)4;/h4*1H3,(H,3,4);/q;;;;+2/p-4 |
| Vlastnosti | |
| Molární hmotnost | 443,4 g/mol |
| Teplota tání | 175 °C (448 K)[1] |
| Teplota varu | rozkládá se |
| Hustota | 2,228 g/cm3 (17 °C)[1] |
| Rozpustnost ve vodě | rozkládá se[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v konentrované kyselině octové a v chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v tetrachlormethanu, benzenu a nitrobenzenu[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H332 H360 H373 H400 H410[1] |
| P-věty | P201 P202 P260 P261 P264 P270 P271 P273 P281 P301+312 P304+312 P304+340 P308+313 P312 P314 P330 P391 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
V pevném octanu olovičitém jsou na Pb4+ centra koordinovány čtyři bidentátní octanové anionty, každý pomocí dvou atomů kyslíku. Atom olova má koordinační číslo 8 a atomy kyslíku vytvářejí zploštělý dvanáctistěn.[2]
Příprava
Octan olovičitý se obvykle připravuje reakcí oxidu olovnato-olovičitého s kyselinou octovou a acetanhydridem, který pohlcuje vodu. Reakce probíhá podle následující rovnice:[3]
- Pb3O4 + 4 Ac2O → Pb(OAc)4 + 2 Pb(OAc)2
Vznikající octan olovnatý může být oxidován na octan olovičitý:
- 2 Pb(OAc)2 + Cl2 → Pb(OAc)4 + PbCl2
Použití
Octan olovičitý je silné oxidační činidlo,[4] lze jej také použít jako zdroj acetyloxyskupin a jako reaktant k zavádění olova do organických sloučenin. V organické chemii má mimo jiné tato využití:
- acetoxylace vazeb C-H u benzyl-, allyl- a α-kyslíkatých etherů, jako je například fotochemická přeměna dioxanu na 1,4-dioxen přes 2-acetoxy-1,4-dioxanový meziprodukt[5] a alfa-pinenu na verbenon[6]
- náhrada bromu v Hofmannově přesmyku[7]
- oxidace hydrazonů na diazosloučeniny, například hexafluoracetonhydrazonu na bis(trifluormethyl)diazomethan[8]
- tvorba aziridinů reakcemi, jako je přeměna N-aminoftalimidu a stilbenu[9]
- Štěpení α-hydroxykyselin[10] a 1,2-diolů za vzniku odpovídajících aldehydů či ketonů, často nahrazuje ozonolýzu; příkladem je oxidace di-n-butyl-tartarátu na n-butyl glyoxalát.[11]
- reakce s alkeny za tvorby γ-laktonů
- oxidace alkoholů obsahujících δ-proton na cyklické ethery[12]
- oxidační štěpení některých allylalkoholů za přítomnosti ozónu:[13][14]
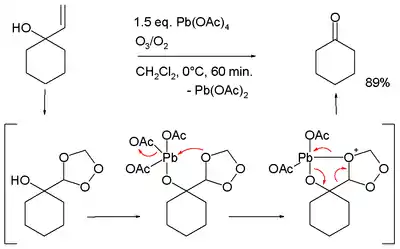
- přeměna acetofenonů na fenylované deriváty kyseliny octové[15]
- Dekarboxylace karboxylových kyselin na alkylhalogenidy při Kochiově reakci[16]
Reference
V tomto článku byl použit překlad textu z článku Lead(IV) acetate na anglické Wikipedii.
- Lead tetracetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- M. Schürmann; F. Huber. A redetermination of lead(IV) acetate. Acta Crystallographica Section C. 1994, s. 1710–1713. ISSN 0108-2701. DOI 10.1107/S0108270194006438.
- J. C. Bailar, Jr. Lead Tetracetate. Inorganic Syntheses. 1939, s. 47–49. ISBN 9780470132326. DOI 10.1002/9780470132326.ch17.
- J. Zýka. Analytical study of the basic properties of lead tetraacetate as oxidizing agent. Pure and Applied Chemistry. 1966, s. 569–581. Dostupné online [cit. 2013-12-19]. DOI 10.1351/pac196613040569.
- Organic Syntheses, Vol. 82, p.99 (2005) Article.
- Organic Syntheses, Coll. Vol. 9, p.745 (1998); Vol. 72, p.57 (1995) Article
- Henry Baumgarten; Howard Smith; Andris Staklis. Reactions of amines. XVIII. Oxidative rearrangement of amides with lead tetraacetate. The Journal of Organic Chemistry. 1975, s. 3554–3561. DOI 10.1351/pac196613040569.
- Organic Syntheses, Coll. Vol. 6, p.161 (1988); Vol. 50, p.6 (1970) Article.
- Organic Syntheses, Coll. Vol. 6, p.56 (1988); Vol. 55, p.114 (1976) Link
- Haruomi Ōeda. Oxidation of some α-hydroxy-acids with lead tetraacetate. Bulletin of the Chemical Society of Japan. 1934, s. 8–14. DOI 10.1246/bcsj.9.8.
- Organic Syntheses, Coll. Vol. 4, p.124 (1963); Vol. 35, p.18 (1955) Article.
- M B Smith, J March. March's Advanced Organic Chemistry (Wiley, 2001) (ISBN 0-471-58589-0)
- O3/Pb(OAc)4: a new and efficient system for the oxidative cleavage of allyl alcohols. Tetrahedron Letters. 2006, s. 6619–6622. DOI 10.1016/j.tetlet.2006.07.020.
- Při přeměměně 1-allylcyklohexanolu na cyklohexanon se nejprve allylová skupina mění na trioxalanovou jako při ozonolýze; takto vzniklá skupina následně reaguje s alkoxyolovem.
- B. Myrboh; H. Ila; H. Junjappa. One-Step Synthesis of Methyl Arylacetates from Acetophenones Using Lead(IV) Acetate. Synthesis. 1981, s. 126–127. DOI 10.1055/s-1981-29358.
- Jay K. Kochi. A New Method for Halodecarboxylation of Acids Using Lead(IV) Acetate. Journal of the American Chemical Society. 1965, s. 2500–2502. DOI 10.1021/ja01089a041.
Externí odkazy
 Obrázky, zvuky či videa k tématu Octan olovičitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Octan olovičitý na Wikimedia Commons


