Oxidace chromovými komplexy
Oxidace chromovými komplexy jsou organické reakce, které slouží k přeměně alkoholů na karbonylové nebo více oxidované sloučeniny působením oxidů a solí Cr6+.[1]
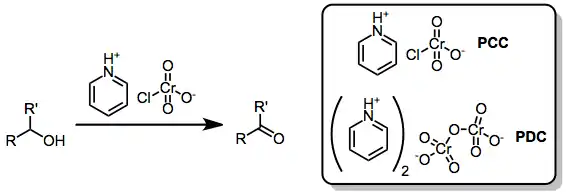
K takovýmto organickým oxidacím se často používají Collinsovo činidlo, chlorchroman pyridinia (PCC) a dichroman pyridinia (PDC), jež jsou vhodnější než anorganické chromové sloučeniny, jako například Jonesovo činidlo.
Pyridinové a pyridiniové komplexy
Chromové komplexy pyridinu a pyridinia mají tu výhodu, že jsou rozpustné v organických rozpouštědlech.
Do první skupiny patří činidla odvozená od komplexu CrO3(pyridin)2.[2]
- Sarettovo činidlo: roztok CrO3(pyridinu)2 v pyridinu. Používá se k selektivním oxidacím primárních a sekundárních alkoholů na karbonylové sloučeniny.
- Collinsovo činidlo je také roztok CrO3(pyridinu)2, ale v dichlormethanu. Existuje Ratcliffova varianta Collinsova činidla, která se liší způsobem přípravy, kdy se přidává oxid chromový k roztoku pyridinu v dichlormethanu.[3]
Druhou skupinou jsou soli pyridinového kationtu (C5H5NH+).
- dichroman pyridinia (PDC) - sůl dichromanového aniontu, [Cr2O7]2-.
- chlorchroman pyridinia (PCC), sůl pyridinia a [CrO3Cl]−.
Tyto soli jsou méně reaktivní, snadněji se s nimi nakládá a vykazují při oxidacích alkoholů vyšší selektivitu než Collinsovo činidlo. Stejně jako i chromové adukty dusíkatých heterocyklických sloučenin mohou provádět řadu oxidací organických sloučenin, jako jsou oxidační cyklizace vytvářející deriváty tetrahydrofuranu a Bablerovy oxidace, kdy se mění allylalkoholy na enony.
Omezení
Oxidace chromovými komplexy mají dvě hlavní omezení; prvním je snížení výtěžnosti vedlejšími produkty. Některá činidla (hlavně PCC) reagují se skupinami citlivými na přítomnost kyselin a používají se tak převážně u oxidací jednodušších substrátů, často v přebytku. Vedlejší produkty lze odstraňovat pomocí adsorbentů, jako jsou křemelina nebo silikagel.
(1)
Mechanismus a stereochemie
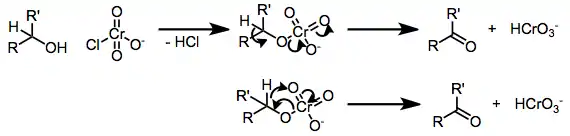
Meziprodukty těchto reakcí jsou estery kyseliny chromové; na karbonylové sloučeniny se rozpadají odštěpením alfa protonů, přičemž se objevují výrazné kinetické izotopové efekty.[4]
(2)
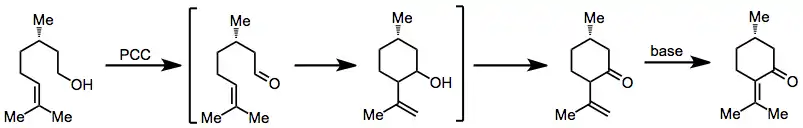
Oxidačními anelacemi alkenolů za přítomnosti PCC vznikají šestičlenné cykly. Tyto procesy pravděpodobně probíhají s úvodními oxidacemi alkoholů, po kterých následuje atak alkenu na nově vytvořený karbonyl a zpětná oxidace na keton. Po přidání zásady může dojít k izomerizaci dvojné vazby, jak na obrázku níže ukazuje rovnice (3).[5]
(3)
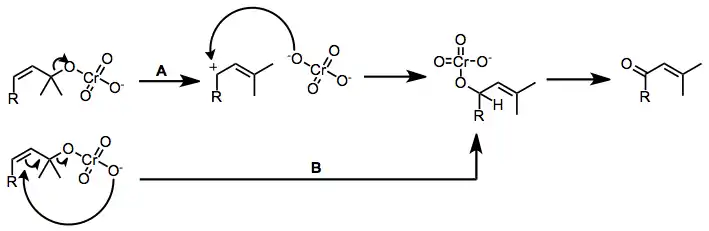
Důležitým dějem, řízeným chromovými komplexy aminů, je oxidační přeskupení terciárních allylalkoholů na enony.[6] Tento proces je řízen kyselostí chromového činidla. Kyselá činidla, jako je PCC, mohou způsobit ionizaci a rekombinaci esteru (dráha A), zatímco zásaditá činidla (Collinsovo) spíše procházejí přímými allylovými přesuny prostřednictvím sigmatropních přesmyků (dráha B).
(4)
Oxidační cyklizace nenasycených alkoholů na cyklické ethery mohou proběhnout [3+2], [2+2],[7] nebo epoxidačním mechanismem. Zkoumání vztahu mezi strukturou a reaktivitou naznačilo průběh reakce přes přímou epoxidaci chromátem.[8] Následně se otevřením epoxidového kruhu a uvolněním chromu vytvoří konečné produkty.
(5)
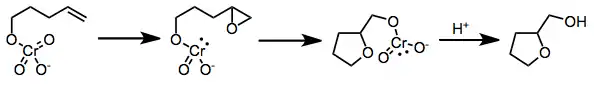
Rozsah
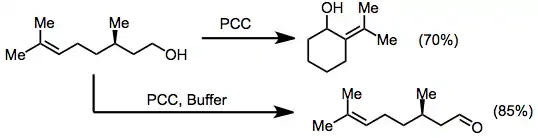
K zamezení odštěpení skupin citlivých na kyseliny lze použít pufry; ty také zpomalují oxidační cyklizace, což vede k oxidaci alkoholů přednostně oproti jiným oxidačním přeměnám. Citronellol, který se za přítomnosti PCC cyklizuje na pugelloly, při použití pufrů není cyklizován.[9][10]
(6)
Oxidační cyklizace lze použít k tvorbě substituovaných tetrahydrofuranů. Cyklizacemi dienolů vznikají dvojice tetrahydrofuranových kruhů v syn-uspořádání.[11]
(7)
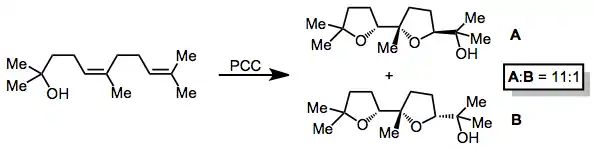
Enony je možné připravit oxidacemi terciárních allylalkoholů pomocí řady různých chrom-aminových činidel; tento postup se nazývá Bablerova oxidace. Reakce je řízena tvorbou více substituované dvojné vazby. (E)-enony se vytváří ve větším množství než (Z)-izomery, příčinou je geometrická izomerizace řízená chromem.[10][12]
(8)
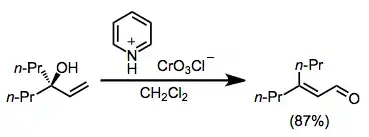
Vhodně substituované nenasycené alkoholy lze oxidačně cyklizovat na tetrahydrofurany, z nichž je možné další oxidací vytvořit tetrahydropyranylkarbonylové sloučeniny.[13]
(9)
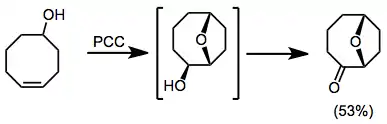
Mimo výše uvedená omezení bývají chromové sloučeniny často neúčinné u oxidací substrátů obsahujících heteroatomy (obzvláště dusík). Koordinace heteroatomů na chrom (a s tím spojená odvázání aminových skupin navázaných původně na kov) vedou k deaktivacím až rozkladům oxidantů.
Srovnání s jinými metodami
Substráty obsahující heteroatomové skupiny, které se mohou vázat na chrom, se častěji než chromovými komplexy aminů oxidují metodami založenými na dimethylsulfoxidu, Swernovou nebo Moffatovou oxidací.[14] Dessův–Martinův perjodinan (DMP) se vyznačuje snadným provedením reakcí, nedochází u něj k tvorbě kovových vedlejších produktů, a je selektivní při oxidacích složitých pozdních meziproduktů chemických syntéz.[15]
K oxidacím allylalkoholů na enony je možné použít jak DMP, tak i oxid manganičitý (MnO2) bez toho, aby docházelo k allylovým přesunům. Tam, kde jsou tyto přesuny žádoucí, se ovšem používají téměř výhradně chromová oxidační činidla.
Katalytickými postupy využívajícími levná a čistá koncová oxidační činidla ve spojení s katalytickými chromových činidel vznikají jen malá množství vedlejších produktů.[16] Vedlejší reakce se ale mohou objevit při použití stechiometrických množství koncových oxidačních činidel.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Oxidation with chromium(VI) complexes na anglické Wikipedii.
- F. A. Luzzio. The Oxidation of Alcohols by Modified Oxochromium(VI)–Amine Reagents. Organic Reactions. 1998. DOI 10.1002/0471264180.or053.01.
- F. A. Luzzio. Oxidation of Alcohols to Aldehydes and Ketones. [s.l.]: [s.n.], 2006. ISBN 0-387-23607-4. DOI 10.1007/0-387-25725-X_1. Kapitola Chromium-based Reagents, s. 1-95.
- J. C. Collins; W. W. Hess. Aldehydes from Primary Alcohols by Oxidation with Chromium Trioxide: Heptanal. Organic Syntheses. 1972. DOI 10.15227/orgsyn.052.0005.
- Banerji, K. K. The Journal of Organic Chemistry, 1988, 53, 2154.
- Corey, E. J.; Boger, D. Tetrahedron Letters, 1978, 19, 2461.
- Luzzio, F. A.; Moore, W. J. The Journal of Organic Chemistry, 1993, 58, 2966.
- Piccialli, V. Synthesis 2007, 2585.
- Beihoffer, L.A; Craven, R.A.; Knight, K.S; Cisson, C.R.; Waddell, T.G. Transition Metal Chemistry 2005, 30, 582.
- Fieser, L. F.; Fieser, M. Reagents for Organic Synthesis; Wiley-Interscience, New York, 1979, 7, 309.
- Babler, J. H.; Coghlan, M. J. Synthetic Communications 1976, 6, 469.
- McDonald, F. E.; Towne, T. B. Journal of the American Chemical Society, 1994, 116, 7921.
- Majetich, G.; Condon, S.; Hull, K.; Ahmad, S. Tetrahedron Letters, 1989, 30, 1033.
- Schlecht, M. F.; Kim, H.-J. Tetrahedron Letters, 1986, 27, 4889.
- Tidwell, T. Organic Reactions 1990, 39, 297.
- Robert J. Boeckman; Kelly M. George. 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one. Encyclopedia of Reagents for Organic Synthesis. 2009. DOI 10.1002/047084289X.rt157m.pub2.
- Muzart, J. Tetrahedron Letters, 1987, 28, 2133.
Literatura
- Poos, G. I.; Arth, G. E.; Beyler, R. E.; Sarrett, L. H. Journal of the American Chemical Society, 1953, 75, 422.
- Ronald Ratcliffe and Ronald Rodehorst. Improved Procedure for Oxidations with the Chromium Trioxide-Pyridine Complex. The Journal of Organic Chemistry. 1970, s. 4000–4001. DOI 10.1021/jo00836a108. (anglicky)