N,N'-dicyklohexylkarbodiimid
N,N′-Dicyklohexylkarbodiimid (zkráceně DCC nebo DCCD)[2] je organická sloučenina se vzorcem (C6H11N)2C, používaná na spojování aminokyselin při umělé syntéze peptidů. Díky nízké teplotě tání lze tuto látku roztavit a tím usnadnit nakládání s ní. Rozpouští se v dichlormethanu, tetrahydrofuranu, acetonitrilu a dimethylformamidu, ve vodě je nerozpustná.
| N,N'-dicyklohexylkarbodiimid | |
|---|---|
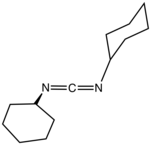
Strukturní vzorec | |
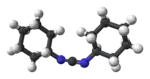
Model molekuly | |
| Obecné | |
| Systematický název | N,N′-dicyklohexylmethandiimin |
| Ostatní názvy | DCC |
| Sumární vzorec | C13H22N2 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 538-75-0 |
| EC-no (EINECS/ELINCS/NLP) | 208-704-1 |
| PubChem | 10868 |
| SMILES | N(=C=N\C1CCCCC1)\C2CCCCC2 |
| InChI | 1S/C13H22N2/c1-3-7-12(8-4-1)14-11-15-13-9-5-2-6-10-13/h12-13H,1-10H2 |
| Vlastnosti | |
| Molární hmotnost | 206,33 g/mol |
| Teplota tání | 34,5 °C (307,6 K)[1] |
| Teplota varu | 122 až 124 °C (395 až 397 K) (0,8 kPa)[1] |
| Rozpustnost ve vodě | rozkládá se[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H311 H317 H318[1] |
| P-věty | P261 P264 P270 P272 P280 P301+312 P302+352 P305+351+338 P310 P312 P321 P322 P330 P333+313 P361 P363 P405 P501[1] |
| Teplota vzplanutí | nad 113 °C (386 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura a spektroskopie
C-N=C=N-C jádro karbodiimidů (N=C=N) je lineární, se strukturou podobnou propadienu. Molekula je symetrická.
Skupinu N=C=N lze identifikovat pomocí infračervené spektroskopie, kde má charakteristickou absorpci při 2117 cm−1.[3] V 15N NMR má posun 275 ppm od kyseliny dusičné a 139 ppm od TMS.[4]
Příprava
DCC se dá připravit několika způsoby. Jedním z nich je reakce cyklohexanaminu s isokyancyklohexanem za přítomnosti octanu palladnatého, jodu a kyslíku, která má výtěžnost 67 %.[5]
- C6H11NH2 + C6H11NC + O2 → (C6H11N)2C + H2O
Byůla také popsána kondenzace dvou isokyanátů za použití OP(MeNCH2CH2)3N jako katalyzátoru, která má 92% výtěžnost:[3]
DCC lze rovněž připravit z dicyklohexylmočoviny s využitím katalyzátoru fázového přenosu. Dicyklohexylmočovina reaguje s arensulfonylchloridem a uhličitanem draselným v toluenu za přítomnosti benzyltriethylamoniumchloridu, přičemž se tvoří DCC s 50% výtěžností.[6]
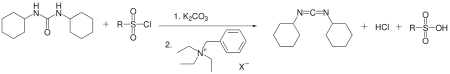 Phase Transfer Catalysis
Phase Transfer Catalysis
Reakce
Tvorba amidů, esterů a peptidů
DCC lze použít jako dehydratační činidlo při přípravě amidů, ketonů a nitrilů.[2] Při těchto reakcich se DCC hydratuje na dicyklohexylmočovinu (DCU), která je nerozpustná ve většině organických rozpouštědel a nerozpouští se ani ve vodě. DCU lze tak oddělit filtrací, i když může být obtížné oddělit jejich zbytky od nepolárních látek. DCC lze použít k obrácení chirality sekundárních alkoholů. Při Steglichově esterifikaci se esterifikují alkoholy, i některé terciární, reakcí s karboxylovou kyselinou za přítomnosti DCC a katalytického množství 4-dimethylaminopyridinu.[7]
Při syntéze bílkovin (například s využitím fluorenylmethyloxykarbonylové skupiny se připojují aminokyseliny na N-konec peptidového řetězce; k navýšení elektrofility karboxylové skupiny se používá aktivace záporně nabitého kyslíku lepší odcházející skupinou, k tomuto účelu slouží DCC. Záporně nabitý kyslík se chová jako nukleofil, který reaguje s centrálním uhlíkem DCC. Tím dojde k napojení DCC na karboxylátovou skupinu, čímž vznikne vysoce elektrofilní meziprodukt, který usnadní nukleofilní reakci koncové aminoskupiny.
Pfitznerova-Moffattova oxidace
Za přítomnnosti dimethylsulfoxidu (DMSO) DCC usnadňuje Pfitznerovu-Moffattovu oxidaci.[8]
Tímto způsobem se oxidují alkoholy na aldehydy a ketony. Na rozdíl od oxidací řízených kovy, jako je Jonesova oxidace, při ní nedochází k „přeoxidování“ na karboxylové kyseliny. Obvykle se používají tři ekvivalenty DCC a 0,5 ekvivalentu zdroje protonů v DMSO. Reakce se ukončuje přidáním kyseliny.
Ostatní reakce
- Reakcí kyseliny s peroxidem vodíku za přítomnosti DCC vzniká peroxidová vazba
- Pomocí DCC lze dehydratovat i alkoholy. Při této reakci se nejprve tvoří O-acylmočovina jako meziprodukt, u kterého proběhne hydrogenolýza za vzniku alkenu:
- RCH(OH)CH2R' + (C6H11N)2C → RCH=CHR' + (C6H11NH)2CO
- Sekundární alkoholy mohou být přeměněny na opačný stereoizomer reakcí s esterem kyseliny mravenčí a následným zmýdelněním. Sekundární alkohol se smísí s DCC, kyselinou mravenčí a silnou zásadou, jako je například methoxid sodný.
Biologické účinky
DCC funguje jako inhibitor ATP syntázy,[9] váže se na jednu z jejich c podjednotek a stericky zabraňuje otočení FO podjednotky.[10]
Bezpečnost
DCC může způsobovat vyrážku.[2]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu N,N'-dicyklohexylkarbodiimid na Wikimedia Commons
Obrázky, zvuky či videa k tématu N,N'-dicyklohexylkarbodiimid na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku N,N'-Dicyclohexylcarbodiimide na anglické Wikipedii.
- Dicyclohexylcarbodiimide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Jeffrey S. Albert, Andrew D. Hamilton, Amy C. Hart, Xiaoming Feng, Lili Lin, Zhen Wang. 1,3‐Dicyclohexylcarbodiimide. EEROS. 2017, s. 1–9. ISBN 9780470842898. DOI 10.1002/047084289X.rd146.pub3. (anglicky)
- J. Tang; T. Mohan; J. G. Verkade. Selective and Efficient Syntheses of Perhydro-1,3,5-triazine-2,4,6-triones and Carbodiimides from Isocyanates Using ZP(MeNCH2CH2)3N Catalysts. Journal of Organic Chemistry. 1994, s. 4931–4938. DOI 10.1021/jo00096a041.
- I. Yavari; J. D. Roberts. Nitrogen-15 Nuclear Magnetic Resonance Spectroscopy. Carbodiimides. Journal of Organic Chemistry. 1978, s. 4689–4690. DOI 10.1021/jo00419a001.
- I. Pri-Bar; J. Schwartz. N,N-Dialkylcarbodiimide Synthesis by Palladium-Catalysed Coupling of Amines with Isonitriles. Chemical Communications. 1997, s. 347–348. DOI 10.1039/a606012i.
- Z. M. Jászay; I. Petneházy; L. Töke; B. Szajáni. Preparation of Carbodiimides Using Phase-Transfer Catalysis. Synthesis. 1987, s. 520–523. DOI 10.1055/s-1987-27992.
- B. Neises; W. Steglich. Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: Tert-Butyl Ethyl Fumarate. Organic Syntheses. 1985, s. 183. DOI 10.1055/s-1987-27992.
- John G. Moffatt. Cholane-24-al. Organic Syntheses. 1967, s. 25. DOI 10.15227/orgsyn.047.0025.
- S. Hong; P. L. Pedersen. ATP synthase and the actions of inhibitors utilized to study its roles in human health, disease, and other scientific areas. Microbiology and Molecular Biology Reviews. 2008, s. 590–641. DOI 10.1128/MMBR.00016-08. PMID 19052322.
- M. Toei; H. Noji. Single-molecule analysis of F0F1-ATP synthase inhibited by N,N-dicyclohexylcarbodiimide. Journal of Biological Chemistry. 2013, s. 25 717 – 25 726. DOI 10.1074/jbc.M113.482455. PMID 23893417.



