Inhibice
Inhibice je v biochemii proces, kdy vazba určité látky způsobí snížení aktivity enzymu.[1] Tím dochází k zamezení či omezení správného průběhu enzymatické reakce.[2] Látky, které takto účinkují, se označují jako enzymatické inhibitory[1] či negativní efektory (opačně zase působí aktivátory).[3] Inhibice může být přirozená, která umožňuje regulaci buněčných procesů, a nepřirozená, kdy se v roli inhibitorů ocitají například různé zplodiny metabolismu, ale i léčiva a jedy.[3] Existuje několik typů inhibice, obvykle se uvádí kompetitivní, nekompetitivní, akompetitivní a smíšená, někdy se zvlášť vyčleňuje i ireverzibilní (nevratná) inhibice.
Mechanismus inhibice je velice rozmanitý. Někdy se inhibitor váže na enzym a zamezuje mu navázat substrát, jindy sice umožní navázání substrátu, ale nemůže dojít k enzymatické reakci. V dalších případech se váže inhibitor až na komplex enzym-substrát (ES) a zamezuje přeměně substrátu.[3]
Povaha inhibitorů
Z chemického hlediska může být inhibitorem téměř cokoliv. Jsou známy ionty kovů schopné inhibice, stejně jako různé nízkomolekulární anorganické látky, ale jako inhibitory se mohou chovat i třeba poměrně vysokomolekulární organické látky. Existuje skupina inhibitorů polypeptidové (bílkovinné) povahy, jeden z nich například blokuje účinky enzymu trypsinu.[3]
Reverzibilní inhibice
Třídění je různé, toto je jen jedno z možných. Někteří autoři dávají přednost řazení smíšené inhibice do skupiny nekompetitivních inhibicí (jako „smíšené nekompetitivní inhibice“). Speciálními případy je inhibice substrátem či produktem dané enzymatické reakce – i ty však zpravidla spadají do jednoho z níže uvedených typů inhibice.[3]
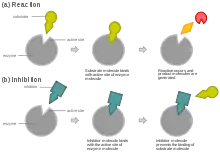
Kompetitivní inhibice
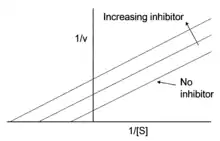
Kompetitivní (soutěživé) inhibitory jsou látky, které soutěží („kompetují“) s molekulami substrátu o vazebné místo na molekule enzymu. Typická je situace, kdy inhibitor tvarem či chemickou strukturou připomíná molekulu substrátu a enzym není schopen mezi nimi rozeznat rozdíl. Následkem toho dochází s určitou pravděpodobností k navázání inhibitoru enzymem, přičemž z tohoto komplexu enzym-substrát nemůže vzniknout produkt. Reakce E + I → EI je však reverzibilní (vratná), takže po určité době dojde k uvolnění inhibitoru a enzym se může znovu „pokusit“ navázat substrát. Znamená to, že se ale snižuje koncentrace volných a tedy dostupných molekul enzymu.[1] Rozsah inhibice závisí zejména právě na poměru koncentrací molekul substrátu a inhibitoru.[3] Tím se vlastně zvyšuje Michaelisova konstanta enzymové reakce (KM), což se ukáže při vynesení na Lineweaverův-Burkův graf (stejně jako skutečnost, že maximální rychlost vmax zůstává konstantní).[1]
Akompetitivní inhibice
Akompetitivní inhibice je jev, kdy se inhibitor váže na komplex enzym-substrát a zamezuje přeměnění substrátu na produkt. V průběhu tohoto typu inhibice tedy vzniká ternární komplex ESI, enzym-substrát-inhibitor. Ve většině případů se tato inhibice uplatňuje u dvousubstrátových reakcí, kdy se inhibitor váže na komplex E-S1, a to do druhého vazebného místa, čímž zamezuje průběhu reakce. Akompetitivní inhibitory snižují mezní rychlost (vmax) i Michaelisovu konstantu (KM), ačkoliv jejich vzájemný poměr zůstává stejný. Účinky akompetitivní inhibice nelze odstranit prostým zvýšením substrátu (na rozdíl od kompetitivní inhibice), paradoxně je aktivita akompetitivního inhibitoru nejnižší při nízké koncentraci substrátu.[1][3]
Nekompetitivní a smíšená inhibice
Nekompetitivní inhibitory se váží na alosterická místa enzymů a nebrání tedy substrátu, aby se navázal do vazebného místa enzymu. Nekompetitivní inhibitory způsobí jen to, že se snižuje rychlost přeměny substrátu na produkt.[3] Inhibitor se přitom váže se stejnou disociační konstantou na volný enzym (E) i na komplex enzym-substrát (ES).[1] Inhibitor za těchto okolností snižuje mezní rychlost (vmax), ačkoliv Michaelisova konstanta zůstává stejná.[3]
Smíšená inhibice je speciálním typem inhibice, kdy dochází k změně Michaelisovy konstanty i mezní rychlosti, ale mění se i jejich poměr.[3]
Ireverzibilní inhibice
Ireverzibilní inhibitory se rovněž označují jako enzymové jedy, protože nevratně poškozují enzym tím, že ho chemicky modifikují či se na něj nevratně navážou. Ve většině případů dochází ke kovalentní vazbě inhibitoru či jeho části na aminokyselinové postranní skupiny enzymu. Tyto kovalentní změny je obtížné či téměř nemožné napravit a situace se nezlepší ani tehdy, je-li inhibitor odstraněn z okolního prostředí. Je třeba ještě vyrobit nové molekuly enzymů, což může trvat dlouho, a tak jsou ireverzibilní inhibitory mnohdy fatální.[4]
Odkazy
Reference
- VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
- Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- VODRÁŽKA, Zdeněk; RAUSCH, Pavel; KÁŠ, Jan. Enzymologie. [s.l.]: VŠCHT v Praze, 1998.
- MURRAY, Robert K., Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell. Harper's Illustrated Biochemistry. [s.l.]: Lange Medical Books/McGraw-Hill; Medical Publishing Division, 2003. ISBN 0-07-138901-6.
Související články
Externí odkazy
 Slovníkové heslo inhibice ve Wikislovníku
Slovníkové heslo inhibice ve Wikislovníku