Kyselina glyoxalová
Kyselina glyoxalová, též kyselina glyoxylová, systematický název kyselina oxoethanová je nejjednodušší oxokyselina, obsahuje vedle sebe aldehydovou a karboxylovou skupinu. Jedná se o přechodnou sloučeninu mezi glyoxalem a kyselinou šťavelovou.
| Kyselina glyoxalová | |
|---|---|

Strukturní vzorec | |
| Obecné | |
| Systematický název | kyselina oxoethanová |
| Triviální název | kyselina glyoxalová |
| Ostatní názvy | kyselina formylmravenčí, kyselina glyoxylová kyselina methanalkarboxylová, karboxylaldehyd |
| Anglický název | Glyoxylic acid |
| Německý název | Glyoxylsäure |
| Funkční vzorec | CHOCOOH |
| Sumární vzorec | C2H2O3 |
| Identifikace | |
| Registrační číslo CAS | 298-12-4 |
| SMILES | C(=O)C(=O)O |
| InChI | 1S/C2H2O3/c3-1-2(4)5/h1H,(H,4,5) |
| Vlastnosti | |
| Molární hmotnost | 74,04 g/mol |
| Teplota tání | 80 °C (353 K) |
| Teplota varu | 111 °C (384 K) |
| Hustota | 1,384 g/cm3 |
| Disociační konstanta pKa | 3,18 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Společně s kyselinou octovou, glykolovou, šťavelovou a glycinem jde o jednu z dvouuhlíkatých karboxylových kyselin.
Výskyt a příprava
Konjugovaná báze této kyseliny se nazývá glyoxylát, jde o meziprodukt glyoxylátového cyklu.
Kyselina glyoxalová se vyrábí oxidací glyoxalu horkou kyselinou dusičnou (kdy vzniká také kyselina šťavelová) nebo ozonolýzou kyseliny maleinové.
V minulosti se vyráběla elektrosynteticky v roztoku kyseliny sírové za použití olověné katody a anody z oxidu olovičitého:[2][3][4]
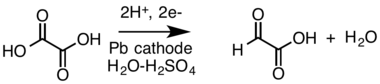
Reakce a použití
Kyselina glyoxalová je asi desetkrát silnější než kyselina octová, její pKa je 3,32.
V přítomnosti zásady dochází k disproporcionaci:
- 2 OCHCOOH + H2O → HOCH2COOH + HOOC–COOH
Bezpečnost
Tato látka není výrazně jedovatá, smrtelná dávka pro krysy je asi 2,5 g/kg.
Reference
V tomto článku byl použit překlad textu z článku Glyoxylic acid na anglické Wikipedii.
- Glyoxylic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- TAFEL, JULIUS; AND FRIEDRICHS, GUSTAV. Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung. Berichte der deutschen chemischen Gesellschaft. 1904, s. 3187-3191. Dostupné online [cit. 19 December 2013]. DOI 10.1002/cber.190403703116. (anglicky)
- COHEN, Julius. Practical Organic Chemistry 2nd Ed.. London: Macmillan and Co. Limited, 1920. Dostupné online. S. 102-104. (anglicky)
- François Cardarelli. Materials Handbook: A Concise Desktop Reference. [s.l.]: Springer, 2008. Dostupné online. ISBN 1-84628-668-9. S. 574. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina glyoxalová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina glyoxalová na Wikimedia Commons

