Komplexy přechodných kovů s alkeny
Komplexy přechodných kovů s alkeny jsou komplexní sloučeniny obsahující jeden nebo více alkenových ligandů. Vyskytují se jako meziprodukty některých katalytických reakcí, při kterých se alkeny mění na jiné organické sloučeniny.[1]
Ve stabilních komplexech se obvykle objevují mono- a dialkeny.
Monoalkeny
Nejjednodušším monoalkenem je ethen. Je od něho odvozen velký počet komplexů, například Zeiseho sůl, dimer chlorobis(ethylen)rhodia (Rh2Cl2(C2H4)4), Cp*2Ti(C2H4) a homoleptický Ni(C2H4)3. K substituovaným monoalkenům patří cyklický cyklookten, vyskytující se mimo jiné v dimeru chlorobis(cyklookten)rhodia. Alkeny obsahující skupiny odtahující elektrony se silně váží na kovy v nízkých oxidačních číslech; jako příklady zde mohou být uvedeny tetrakyanoethylen (TCNE), tetrafluorethylen, maleinanhydrid a estery kyseliny fumarové. Tvoří adukty s řadou kovů v oxidačním čísle 0.[1]
Dieny, trieny, polyeny, ketoalkeny a ostatní složitější alkenové ligandy
Butadien, cyklookta-1,5-dien a norbornadien patří mezi dobře prozkoumaná chelatační činidla. Na kovy se prostřednictvím několika uhlíkových center mohou také vázat trieny i některé tetraeny; k takovým ligandům patří například cykloheptatrien a cyklooktatetraen. Příslušné vazby se často popisují pomocí hapticity. Ketoalkeny jsou tetrahaptoligandy a stabilizují vysoce nenasycené nízkovalentní kovy, například u trikarbonylu (benzylidenaceton)železa a tris(dibenzylidenaceton)dipalladia.
- Komplexy kovů s alkeny
2.png.webp) Bis(cyklooktadien)nikl, používaný jako katalyzátor
Bis(cyklooktadien)nikl, používaný jako katalyzátor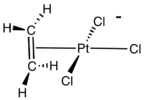 První známý komplex alkenu, anion Zeiseho soli.
První známý komplex alkenu, anion Zeiseho soli.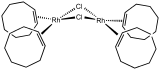 chlorobis(cyklookten)rhodia, zdroj RhCl.
chlorobis(cyklookten)rhodia, zdroj RhCl.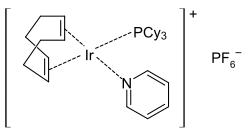 Crabtreeův katalyzátor, vysoce aktivní katalyzátor hydrogenace
Crabtreeův katalyzátor, vysoce aktivní katalyzátor hydrogenaceiron-tricarbonyl-2D-skeletal.png.webp) Trikarbonyl (benzylidenaceton)železa, zdroj Fe(CO)3.
Trikarbonyl (benzylidenaceton)železa, zdroj Fe(CO)3.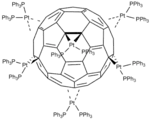 [[Et3P]2Pt]6(η2:η2:η2:η2:η2:η2-C60), komplex fullerenu
[[Et3P]2Pt]6(η2:η2:η2:η2:η2:η2-C60), komplex fullerenu3.png.webp) Mo(C7H8)(CO)3, komplex of cykloheptatrienu
Mo(C7H8)(CO)3, komplex of cykloheptatrienu2.svg.png.webp) Biscyklooktatetraenželezo (Fe(C8H8)2), komplex cyklooktatetraenu
Biscyklooktatetraenželezo (Fe(C8H8)2), komplex cyklooktatetraenu(CO)4.png.webp) Tetrakarbonyl (norbornadien)molybdenu, zdroj Mo(CO)4
Tetrakarbonyl (norbornadien)molybdenu, zdroj Mo(CO)43.svg.png.webp) (Xylylen)Fe(CO)3, příklad stabilizace nestabilního alkenu komplexací
(Xylylen)Fe(CO)3, příklad stabilizace nestabilního alkenu komplexací
Struktura
(C2F4).svg.png.webp)
Vazby mezi alkeny a přechodnými kovy se popisují Dewarovým–Chattovým–Duncansonovým modelem, ve kterém se objevuje dodávání elektronů π orbitalů alkenu do prázdných orbitalů kovu. Tuto interakci podporuje sdílení elektronů s protivazebnými orbitaly alkenu. Rané kovy v nízkých oxidačních číslech (například TiII, ZrII a NbIII) jsou silné pí donory a jejich alkenové komplexy se často popisují jako metalocyklopropany. Reakcemi těchto sloučenin s kyselinami vznikají příslušné alkany. Pozdější kovy (IrI, Pt2), jež jsou slabšími pí donory, interagují s alkeny podobně jako Lewisovy kyseliny s Lewisovými zásadami. Obdobně je C2F4 lepším pí akceptorem než C2H4, což se projevuje na délkách vazeb kov-uhlík.[2]
- Bonding images
 Orbitalové interakce u koplexů kovů s ethenem podle Dewarova–Chattova–Duncansonova modelu
Orbitalové interakce u koplexů kovů s ethenem podle Dewarova–Chattova–Duncansonova modelu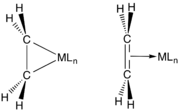 Dvojice krajních zobrazení interakcí M---C2H4
Dvojice krajních zobrazení interakcí M---C2H4
Rotační bariéry
Bariéry rotace alkenů kolem vektoru vycházejícího z atomu kovu lze považovat za ukazatele síly vazeb kov-alken. K analýze těchto rotačních bariér jsou vhodné komplexy s nízkou symetrií. U CpRh(C2H4)(C2F4) je rotační bariéra ethenového ligandu přibližně 50 kJ/mol; u vazby Rh-C2F4 nebyla žádná rotace pozorována.[3]
Reakce a použití
Alkenové ligandy po vzniku komplexu ztrácejí většinu vlastností vyplývajících z přítomnosti dvojných vazeb. Při mezimolekulárním ataku alkylovými a hydridovými ligandy dochází k tvorbě nových alkylových komplexů. Kationtové komplexy alkenů mohou být atakovány nukleofily.[1]
Katalýza
Komplexy kovů a alkenů jsou mnoha reakcí alkenů katalyzovaných přechodnými kovy; patří sem Zieglerovy–Nattovy katalyzátory u polymerizací, hydrogenace, hydroformylace a řada dalších reakcí.[4]
Oddělování alkanů
Protože se alkeny většinou vytváří ve směsích s alkany, tak je důležité je od sebe oddělit. Příslušné postupy jsou často založené na transportních membránách obsahujících stříbrné nebo měďné soli, které se vratně navazují na alkeny.[5]
Při argentační chromatografii se k analýze organických sloučenin podle počtu a druhu alkenových skupin používají stacionární fáze obsahující stříbrné soli. Tento postup se často používá při analýze nenasycených složek tuků a mastných kyselin.[6]
Výskyt
Komplexy kovů a alkenů jsou v přírodě vzácné; výjimku tvoří případ, kdy ethen ovlivňuje zrání ovoce navázáním na měďné centrum transkripčního faktoru.[7]
Reference
V tomto článku byl použit překlad textu z článku Transition metal alkene complex na anglické Wikipedii.
- Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim ISBN 3-527-29390-6
- J. A. Evans; D. R. Russell. The Crystal Structures of Ethylene and Tetrafluoroethylene Complexes of Rhodium(I). Journal of the Chemical Society D: Chemical Communications. 1971, s. 197. DOI 10.1039/C29710000197.
- Richard Cramer; Jules B. Kline; John D. Roberts. Bond Character and Conformational Equilibration of Ethylene- and Tetrafluoroethylenerhodium Complexes from Nuclear Magnetic Resonance Spectra. Journal of the American Chemical Society. 1969, s. 2519–2524. DOI 10.1021/ja01038a021.
- Piet W. N. M. van Leeuwen "Homogeneous Catalysis: Understanding the Art", 2004, Wiley-VCH, Weinheim. ISBN 1-4020-2000-7
- Maryam Azhin; Tahereh Kaghazchi; Mohammad Rahmani. Review on Olefin/Paraffin Separation Using Reversible Chemical Complexation technology. Journal of Industrial and Engineering Chemistry. 2008, s. 622–638. DOI 10.1016/j.jiec.2008.04.014.
- Boryana Nikolova-Damyanova. Principles of Silver Ion Complexation with Double Bonds [online]. Dostupné online.
- Jose M. Alonso, Anna N. Stepanova "The Ethylene Signaling Pathway" Science 2004, Vol. 306, pp. 1513-1515. DOI:10.1126/science.1104812