Glyoxal
Glyoxal (systematický název ethandial) je organická sloučenina se vzorcem OCHCHO. Je to nejjednodušší dialdehyd (aldehyd s dvěma aldehydovými skupinami). Za standardních podmínek se jedná o žlutou kapalinu, která se odpařuje za vzniku zelených par. Jeho struktura je složitější, než jak je běžně zobrazována, protože tvoří hydráty a oligomery. Vyrábí se průmyslově jako prekurzor mnoha dalších látek.
| Glyoxal | |
|---|---|
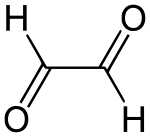
strukturní vzorec | |
model molekuly | |
| Obecné | |
| Systematický název | ethandial |
| Ostatní názvy | oxaldehyd, oxalaldehyd, aldehyd kyseliny šťavelové/ethandiové |
| Anglický název | ethanedial (systematický název) oxaldehyde |
| Německý název | Glyoxal |
| Funkční vzorec | (CHO)2 |
| Sumární vzorec | C2H2O2 |
| Vzhled | žlutá kapalina |
| Identifikace | |
| Registrační číslo CAS | 107-22-2 |
| PubChem | 7860 |
| ChEBI | 34779 |
| SMILES | C(=O)C=O |
| InChI | 1S/C2H2O2/c3-1-2-4/h1-2H |
| Vlastnosti | |
| Molární hmotnost | 58,04 g/mol |
| Teplota tání | 15 °C (288 K) |
| Teplota varu | 51 °C (324 K) |
| Hustota | 1,27 g/cm3 |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | −4 °C (269 K) |
| Teplota vznícení | 285 °C (558 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chemické vlastnosti
Oxidací jedné aldehydové skupiny glyoxalu vzniká kyselina glyoxalová, oxidací obou kyselina šťavelová. Redukcí jedné skupiny vznikne glykolaldehyd, redukcí obou ethylenglykol a oxidací jedné a redukcí druhé -CHO skupiny kyselina glykolová.
Výroba
Glyoxal poprvé vyrobil německo-britský chemik Heinrich Debus reakcí ethanolu s kyselinou dusičnou.
Komerčně se vyrábí oxidací plynného ethylenglykolu za přítomnosti stříbrného nebo měděného katalyzátoru nebo oxidací acetaldehydu kyselinou dusičnou. Nejvíce se jej vyrobí prvním uvedeným způsobem, který začal být používán ve francouzském Lamotte roku 1960. Největším výrobcem je německý BASF (kolem 60 000 tun za rok). Další výrobci jsou také ve Spojených státech amerických a v Číně.
Tuto látku lze rovněž připravit v laboratoři oxidací acetaldehydu kyselinou seleničitou.
Použití
Glyoxal je cenná surovina v organické syntéze, používá se například na syntézu heterocyklů jako jsou imidazoly. V laboratoři se běžně používá ve formě 1,4-dioxan-2,3-diolu, bis(poloacetalu) s ethylenglykolem. Tato sloučenina je komerčně dostupná.
Roztoky glyoxalu mohou být také použity k fixaci vzorku v histologii.
Uchovávání v roztoku
Glyoxal je obvykle dodáván ve 40% vodném roztoku. Jako ostatní nižší aldehydy tvoří hydráty. Tyto hydráty ovšem kondenzují za vzniku oligomerů, jejichž přesná struktura není známa. Pro většinu použití není přesné složení důležité. Komerčně se prodávají dva hydráty glyoxalu:
- glyoxaldimer dihydrát: [(CHO)2]2[H2O]2, 1,4-dioxan-trans-2,3-diol (CAS 4845-50-5, teplota tání 91–95 °C),
- glyoxaltrimer dihydrát: [(CHO)2]3(H2O)2 (CAS 4405-13-4).
Předpokládá se, že v roztocích s koncentrací méně než 1 M převažuje monomerní forma a při vyšších koncentracích převažuje dimer. Dimer a trimer lze díky jejich nizké rozpustnosti vysrážet z roztoku o teplotě nižší než 4 °C.
Výskyt
Byla zjištěna přítomnost glyoxalu (ve stopovém množství) v atmosféře, kde může vzniknout jako produkt oxidace uhlovodíků.[2]
Podobné sloučeniny
Reference
V tomto článku byl použit překlad textu z článku Glyoxal na anglické Wikipedii.
- Glyoxal. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- VOLKAMER, Rainer. A missing sink for gas‐phase glyoxal in Mexico City: Formation of secondary organic aerosol. Geophys. Res. Lett.. 2007, s. 19. DOI 10.1029/2007gl030752. (anglicky)

