Diethylazodikarboxylát
Diethylazodikarboxylát, zkráceně DEAD, je organická sloučenina se vzorcem CH3CH2O2CN=NCO2CH2CH3. V její molekule jsou dvě ethylesterové skupiny navázány na azoskupinu. Jedná se o významný reaktant v organické syntéze, který však při zahřívání může vybouchnout.
| Diethylazodikarboxylát | |
|---|---|
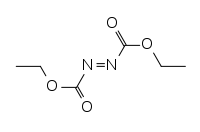
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | diethyl-diazendikarboxylát |
| Ostatní názvy | DEAD |
| Funkční vzorec | CH3CH2O2CN=NCO2CH2CH3 |
| Sumární vzorec | C6H10N2O4 |
| Vzhled | oranžová až červenooranžová kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 1972-28-7 |
| EC-no (EINECS/ELINCS/NLP) | 217-821-7 |
| PubChem | 220568 |
| SMILES | O=C(/N=N/C(=O)OCC)OCC |
| InChI | 1S/C6H10N2O4/c1-3-11-5(9)7-8-6(10)12-4-2/h3-4H2,1-2H3/b8-7+ |
| Vlastnosti | |
| Molární hmotnost | 174,15 g/mol |
| Teplota tání | 6 °C (279 K) |
| Teplota varu | 104,5 °C (377,6 K) |
| Hustota | 1,11 g/cm3 |
| Index lomu | 1,420 (20 °C) |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| H-věty | H240 H302 H312 H315 H319 H332 H335[2] |
| P-věty | P210 P220 P234 P261 P264 P270 P271 P280 P301+310 P301+312 P302+352 P304+312 P304+340 P305+351+338 P312 P321 P322 P330 P332+313 P337+313 P362 P363 P370+378 P370+380+375 P403+233 P403+235 P405 P411 P420 P501[2] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
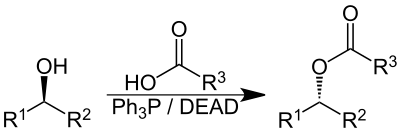
DEAD je aza-dienofil a silné dehydrogenační činidlo, lze jej použít k přeměně alkoholů na aldehydy, thiolů na disulfidy a hydrazosloučenin na azosloučeniny; rovněž jde o dobrý akceptor elektronů. Používá se v mnoha reakcích, z nichž je nejvýznamnější Micunobova reakce, používaná na přípravu aminů, azidů, etherů, thioetherů a esterů z příslušných alkoholů.[3] Používá se při výrobě mnoha léčiv, jako jsou například zidovudin, používaný na léčbu AIDS.
Vlastnosti
DEAD je oranžová až červenooranžová kapalina, v průběhu reakcí se měnící na žlutou až bezbarvou látku. Je rozpustný v řadě organických rozpouštědel, jako jsou toluen, chloroform, ethanol,[4] tetrahydrofuran a dichlormethan[5][6] je ovšem prakticky nerozpustný ve vodě nebo tetrachlormethanu; ve vodě se však rozpouští lépe než podobný dimethylazodikarboxylát.[7]
DEAD je velmi dobrý akceptor elektronů, snadno oxiduje roztok jodidu sodného v kyselině octové. Rovněž reaguje s hydrátem hydrazinu za vzniku diethyl hydrazodikarboxylátu a plynného dusíku. Výpočty na základě LCAO-MO má neobvykle neobsazený vazebný orbital, díky čemuž snadno odstraňuje vodík z různých sloučenin. Světlem podporované odštěpení vodíku pomocí DEAD bylo popsáno u isopropylalkoholu, kde vedlo ke vzniku pinakolu a tetraethyl tetrazanetetrakarboxylátu, a u acetaldehydu, kde se vytvořil diacetyl a diethylhydrazodikarboxylát. Podobně reakcemi s ethanolem a cyklohexanolem vznikají acetaldehyd a cyklohexanon. Tyto reakce lze provést i beze světla, pak ovšem mají nižší výtěžnost.[4] DEAD je tak aza-dienofil a dehydrogenační činidlo, použitelné k přeměně alkoholů na aldehydy, thiolů na disulfidy a hydrazosloučenin na azosloučeniny. Také se účastní pericyklických reakcí s alkeny a dieny enovým a Dielsovým–Alderovým mechanismem.[8]
Příprava
Diethylazodikarnoxylát lze zakoupit nebo připravit v laboratoři, obzvláště pokud je potřeba jako čistá látka. Při přípravě dochází nejprve k alkylaci hydrazinu ethyl-chlorformiátem a poté se vzniklý diethylhydrazodikarboxylát nechá reagovat s chlorem, kyselinou chlornou a koncentrovanou kyselinou dusičnou. Reaktanty se přidávají pomalu, aby teplota reakční směsi nepřesáhla 20 °C. Diethylhydrazodikarboxylát je pevná látka s teplotou tání 131–133 °C, vůči zahřívání výrazně odolnější než DEAD, obvykle se vysouší při teplotě kolem 80 °C.[7][9]
Použití
Micunobova reakce
DEAD se používá jako reaktant v Micunobově reakci, kde vytváří adukty s fosfiny (obvykle s trifenylfosfinem) a napomáhá přípravě esterů, etherů, aminů a thioetherů z příslušných alkoholů. Při reakci obvykle dochází k inverzi stereochemické konfigurace.
Reakci objevil v roce 1967 Ojo Micunobu,[10] jeho přezkum využití diethylazodikarboxylátu z roku 1981 patří k nejcitovanějším chemickým článkům.[11][12]
Micunobova reakce má využití při přípravě řady přírodních látek i léčiv.
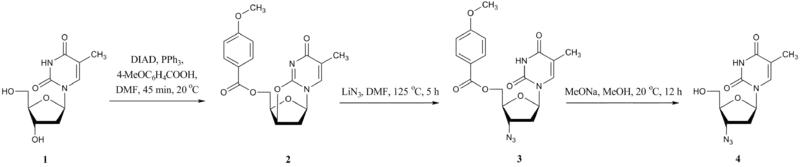
Ve výše uvedené reakci, při které lze místo DEAD použít DIAD, se thymidin 1 mění na derivát 2, ue kterého se poté stává zidovudin 4 (často nazývaný azidothymidin nebo AZT), významné antivirotikum, používané mimo jiné na léčbu AIDS.[13][14][15] Dalším příkladem Micunobovy reakce s využitím diethylazodikarboxylátu používané na přípravu léčiv je příprava bis[(pivaloyloxy)methyl [PIVz] derivátu 2’-deoxy-5-fluoruridin 5’-monofosfátu (FdUMP), používaného při chemoterapii.[16]
Michaelova reakce
Azoskupina v molekule DEAD je silným Michaelovým akceptorem. Za přítomnosti měďnatých katalyzátorů DEAD zprostředkovává přeměnu β-ketoesterů na příslušné deriváty hydrazinu.[17]
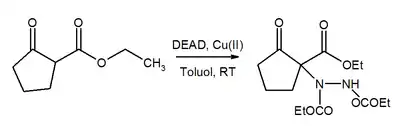
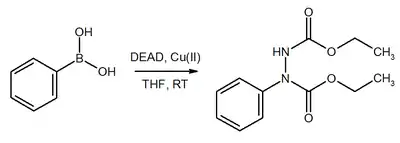
Substituce esterů kyseliny borité probíhá podobně.[18]
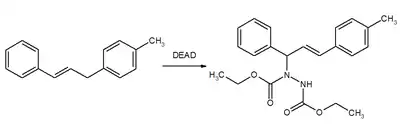
Ostatní reakce
DEAD se používá při některých Dielsových–Alderových reakcích, jako je například příprava bicyklo[2.1.0]pentanu.[19] Také se využívá k tvorbě Baylisových–Hillmanových aduktů z akrylátů.[20]
DEAD je možné použít na přípravu heterocyklických sloučenin, například pyrazoliny z α,β-nenasycených ketonů.[21]

DEAD také může sloužit jako enofil při enových reakcích.
Bezpečnost
DEAD je jedovatý a citlivý na náraz a světlo; v čisté formě může vybuchnout, je-li zahřát nad 100 °C.[22][5][23]
Reference
V tomto článku byl použit překlad textu z článku Diethyl azodicarboxylate na anglické Wikipedii.
- Safety (MSDS) data for diethyl azodicarboxylate Msds.chem.ox.ac.uk. Retrieved on 2011-03-15
- Diethoxycarbonyldiazene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Barbara Czakó. Strategic applications of named reactions in organic synthesis : background and detailed mechanisms; 250 named reactions. [s.l.]: Elsevier, 2009. ISBN 9780123694836.
- Fumio Yoneda; Kunio Suzuki; Yoshihiro Nitta. A new hydrogen-abstracting reaction with diethyl azodicarboxylate. The Journal of Organic Chemistry. 1967, s. 727–729. ISSN 0022-3263. DOI 10.1021/jo01278a049.
- W. L. F. Armarego. Purification of laboratory chemicals. [s.l.]: Butterworth-Heinemann, 2009-05-22. Dostupné online. ISBN 978-1-85617-567-8. S. 124-.
- Kelmara K. Kelly (2009) Novel isotope effects and organic reaction mechanisms, PhD thesis, Texas A&M University, p. 81
- KAUER, J. C. Diethyl azodicarboxylate. Org. Synth.. Dostupné online. (anglicky); Coll. Vol.. S. 411. (anglicky)
- Eric J. Stoner; Amy C. Hart. Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. [s.l.]: [s.n.], 2010. ISBN 978-0471936237. DOI 10.1002/047084289X.rd176.pub2. Kapitola Diethyl Azodicarboxylate.
- Rabjohn, N. Diethyl azodicarboxylate. Organic Syntheses. 1948, s. 58. DOI 10.15227/orgsyn.028.0058. (anglicky)
- O. Mitsunobu; Y. Yamada. Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts. Bulletin of the Chemical Society of Japan. 1967, s. 2380–2382. DOI 10.1246/bcsj.40.2380.
- Oyo Mitsunobu. The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products. Synthesis. 1981, s. 1–28. DOI 10.1055/s-1981-29317.
- Více než 4300 citací k březnu 2011 podle Web of Science
- Czernecki, Stanislas and Valery, Jean-marc "Process for preparing AZT (3'-azido-3'-deoxy-thymidine) and related compounds" Šablona:US patent issued 23 June 1992
- CZERNECKI, Stanislas; VALÉRY, Jean-Marc. An Efficient Synthesis of 3′-Azido-3′-deoxythymidine (AZT). Synthesis. 1991, s. 239. DOI 10.1055/s-1991-26434. (anglicky)
- Kim L. Dueholm; Youssef L. Aly; Per T. Jørgensen; Ahmed A. El-Barbary; Erik B. Pedersen; Claus Nielsen. Convergent synthesis of 2′,3′-dideoxy-3′-methylthio and 2′,3′-dideoxy-3′-mercapto nucleosides and their disulfide analogues — Potential anti-HIV agents. Monatshefte für Chemie - Chemical Monthly. 1993, s. 37–53. DOI 10.1007/BF00808508.
- David Farquhar; Saeed Khan; Devendra N. Srivastva; Priscilla P. Saunders. Synthesis and Antitumor Evaluation of Bis[(pivaloyloxy)methyl] 2'-Deoxy-5-fluorouridine 5'-Monophosphate (FdUMP): A Strategy To Introduce Nucleotides into Cells. Journal of Medicinal Chemistry. 1994, s. 3902–3909. DOI 10.1021/jm00049a009. PMID 7966151.
- Ionic and Covalent Copper(II)-Based Catalysts for Michael Additions. The Mechanism. The Journal of Organic Chemistry. 2004, s. 6834–6842. DOI 10.1021/jo049373z. PMID 15387609.
- Takeshi Uemura. Copper Salt Catalyzed Addition of Arylboronic Acids to Azodicarboxylates. The Journal of Organic Chemistry. 2005, s. 8631. DOI 10.1021/jo051387x. PMID 16209627.
- P. G. Gassman. Bicyclo[2.1.0]pentane. Organic Syntheses. 1969, s. 1. ISSN 0078-6209. DOI 10.15227/orgsyn.049.0001.
- Min Shi. Aza-Baylis–Hillman reactions of diisopropyl azodicarboxylate or diethyl azodicarboxylate with acrylates and acrylonitrile. Tetrahedron. 2004, s. 2083–2089. DOI 10.1016/j.tet.2003.12.059.
- Vijay Nair; Akkattu T. Biju. A Novel Reaction of the "Huisgen Zwitterion" with Chalcones and Dienones: An Efficient Strategy for the Synthesis of Pyrazoline and Pyrazolopyridazine Derivatives. Angewandte Chemie International Edition. 2007, s. 2070–2073. DOI 10.1002/anie.200604025. PMID 17286329.
- Safety (MSDS) data for diethyl azodicarboxylate. Msds.chem.ox.ac.uk. Retrieved on 2011-03-15.
- G. C. Barrett. Amino acid derivatives: a practical approach. [s.l.]: Oxford University Press, 1999. ISBN 978-0-19-855853-8. S. 119-.
Externí odkazy
 Obrázky, zvuky či videa k tématu Diethylazodikarboxylát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Diethylazodikarboxylát na Wikimedia Commons