Benzen
Benzen, popř. benzol (příp. pod značkou „⌬“ či „⏣“), je organická sloučenina (uhlovodík patřící mezi areny), se sladkým zápachem. Při pokojové teplotě je to bezbarvá, hořlavá a toxická kapalina známá pro své karcinogenní účinky.[2] Benzen má menší hustotu než voda a ve vodě je jen málo rozpustný[3]. Hořením se uvolňují saze. Uhlovodíkový zbytek (funkční skupina) vytvořený od benzenu se nazývá fenyl. V přírodě se benzen vyskytuje např. v ropě.
| Benzen | |
|---|---|
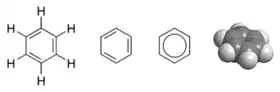
Struktura benzenu - různé chemické vzorce a tvar molekuly | |
| Obecné | |
| Systematický název | benzen |
| Anglický název | benzene |
| Sumární vzorec | C6H6 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 71-43-2 |
| EC-no (EINECS/ELINCS/NLP) | 200-753-7 |
| Indexové číslo | 601-020-00-8 |
| Vlastnosti | |
| Molární hmotnost | 78,11 g/mol |
| Teplota tání | 5,5 °C |
| Teplota varu | 80,1 °C |
| Hustota | 0,878 6 g/cm³ |
| Viskozita | 0,652 cP (20 °C) |
| Rozpustnost ve vodě | 1,79 g/l (25 °C) |
| Struktura | |
| Dipólový moment | 0 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H350 H340 H372 H304 H319 H315 |
| R-věty | R45 R46 R11 R36/38 R48/23/24/25 R65 |
| S-věty | S53 S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Historie
Benzen objevil roku 1825 britský vědec Michael Faraday v ropě. V roce 1833 se povedlo německému chemikovi Eilhardu Mitscherlichovi připravit benzen destilací kyseliny benzoové a sloučeninu pojmenoval benzin. O dvanáct let později izoloval benzen z dehtu anglický chemik Charles Mansfield. Čtyři roky po svém objevu začal jako první na světě průmyslově vyrábět benzen svojí metodou.
Prvním kdo znázornil benzenové jádro nákresem s kruhem odpovídajícím sdíleným elektronům byl roku 1861 karlovarský rodák, chemik Johann Josef Loschmidt; není však prokázané, že znal podrobně zvláštní strukturu benzenu. Tu objevil až roku 1865 německý chemik Friedrich August Kekulé, potomek emigranta, který odešel z českých zemí po bitvě na Bílé hoře v roce 1620.
Struktura molekuly benzenu
_1964%252C_MiNr_440.jpg.webp)
Molekula má tvar šestiúhelníku, v jehož vrcholech jsou atomy uhlíku; ke každému z nich se váže jeden atom vodíku. Protože atomy uhlíku jsou čtyřmocné, v nejjednodušším přiblížení lze vazby mezi nimi považovat střídavě za jednoduché a dvojné (tj. vazby konjugované). Vzdálenost mezi atomy uhlíku je obecně pro tyto vazby odlišná, avšak v benzenu její hodnota odpovídá přibližně průměru mezi délkou jednoduché a dvojné vazby. Ukazuje se, že elektrony v benzenu jsou delokalizované v celém jádru molekuly, což se často v strukturním vzorci označuje pomocí kruhu vepsaného do šestiúhelníku. Benzenové jádro je velmi stabilní a je součástí řady dalších sloučenin, například polyaromatických uhlovodíků, jako je naftalen.
Příprava
- frakční destilací dehtu
- dekarboxylací kyseliny benzoové
- dehydrogenací cyklohexanu
- C6H12 → C6H6 + 3H2
- hydrogenolýzou toluenu
- trimerizací ethynu
- 3 CH≡CH → C6H6
- suchou destilací směsi benzoátu sodného a hydroxidu sodného
Využití

Benzen se používá v průmyslu jako důležité rozpouštědlo a jako výchozí látka mj. pro výrobu léčiv, kompaktních disků, plastů, syntetické pryže, barviv a výbušnin. V malém množství se přidává do benzínu pro zlepšení oktanového čísla. Využívá se i k výrobě kosmetických přípravků. Pomocí benzenu se připravují také další důležité chemikálie, především styren, který se používá na výrobu polystyrenu, fenol a cyklohexan používaný při zpracování nylonu.
Zdroje v prostředí a zdravotní rizika
Podstatným zdrojem benzenu v prostředí jsou zplodiny z automobilové dopravy, ale i jeho vypařování z motorových paliv během manipulace, distribuce a skladování.[4] Srovnatelným zdrojem siloxanů však mohou být pouhé hygienické prostředky.[5]
Vdechování malého množství benzenu může způsobit bolest hlavy, pocit únavy, zrychlení srdečního tepu, chvění a ztrátu vědomí. Velká koncentrace benzenu ve vzduchu může mít za následek i smrt. Benzen poškozuje kostní dřeň a způsobuje chudokrevnost. Benzen je IARC klasifikován jako karcinogen skupiny 1 (rakovinotvorný pro člověka), přičemž způsobuje zejména leukemii a rakovinu plic.[2]
Znečištění v Česku
Znečištění ovzduší benzenem monitoruje Státní zdravotní ústav na 21 měřících stanicích v České republice. Platný limit činí 5 μg·m−3 v ročním průměru a v roce 2005 byl překročen na 3 stanicích v Ostravě a na jedné v Praze. Nejvyšší roční průměr v Ostravě činil 10,26 μg·m−3, v Praze 2 v Legerově ulici 5,3 μg·m−3. Asi 9,3 % obyvatel monitorovaných oblastí žije v prostředí, kde znečištění překračuje platný limit.[6]

Benzen je lidský karcinogen. V potravinách nesmí být obsažen. Benzoan sodný v kombinací s askorbovou kyselinou (Vitamín C) se mění na benzen.[zdroj?] Použití benzoanů jako konzervačních činidel u potravin je striktně omezeno.
Reference
- Benzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- International Agency for Research on Cancer: Benzene - Summaries & Evaluations
- ARNOLD, D.; PLANK, C.; ERICKSON, E. Solubility of Benzene in Water. Industrial & Engineering Chemistry Chemical & Engineering Data Series. Roč. 1958, čís. 3, s. 253. DOI 10.1021/i460004a016.
- Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví, Český a Slovenský dopravní klub 1996, ISBN 80-901339-4-0
- https://phys.org/news/2018-04-daily-emissions-personal-products-car.html - Daily emissions from personal care products comparable to car emissions: study
- Miroslav Šuta: Chemické látky v životním prostředí a zdraví (Ekologický institut Veronica, Brno 2008, ISBN 978-80-87308-00-4)
Externí odkazy
 Obrázky, zvuky či videa k tématu benzen na Wikimedia Commons
Obrázky, zvuky či videa k tématu benzen na Wikimedia Commons  Encyklopedické heslo Benzol v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Benzol v Ottově slovníku naučném ve Wikizdrojích Encyklopedické heslo Benzolová theorie v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Benzolová theorie v Ottově slovníku naučném ve Wikizdrojích- (česky) Benzen – charakteristika látky v Integrovaném registru znečišťování
- (anglicky) WHO: Benzene, Air Quality Guidelines – Second Edition, Chapter 5.2


