Kyselina siřičitá
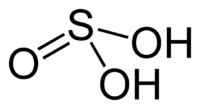
Kyselina siřičitá (chemický vzorec H2SO3) patří ke středně silným kyselinám. Je to dvojsytná kyselina. Je součástí kyselých dešťů. Je známa pouze v roztocích, ve kterých vzniká rozpouštěním oxidu siřičitého:
- SO2 + H2O → H2SO3
| Kyselina siřičitá | |
|---|---|
 | |
| Obecné | |
| Systematický název | kyselina siřičitá |
| Latinský název | Acidum sulfurosum |
| Anglický název | Sulfurous acid |
| Německý název | Schweflige Säure |
| Sumární vzorec | H2SO3 |
| Identifikace | |
| Registrační číslo CAS | 7782-99-2 |
| Vlastnosti | |
| Molární hmotnost | 82,06 g/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R20, R34 |
| S-věty | S1/2, S9, S26, S36/37/39, S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Jestliže se její roztok zahřívá, dochází k zpětné reakci, tj. vzniká voda a uvolňuje se oxid siřičitý.
Kyselina siřičitá disociuje (štěpí se na ionty) ve dvou stupních:
- H2SO3 → H+ + HSO3−
- HSO3− → H+ + SO32−
Kyselina siřičitá tvoří dva typy solí: siřičitany a hydrogensiřičitany. Siřičitany se na vzduchu slučují s kyslíkem a tím se oxidují na sírany. Kyselina siřičitá a její soli mají redukční vlastnosti. Příkladem je tato reakce s kyselinou dusitou:
- 2HNO2 + H2SO3 → 2NO + H2SO4 + H2O
Kyselina siřičitá odebírá kyselině dusité jeden kyslík, tím ji redukuje na oxid dusnatý, a sama odebraný kyslík přijímá, tím se oxiduje na kyselinu sírovou.
Siřičitany alkalických kovů se zahříváním rozkládají a jejich rozkladem vzniká síran a sulfid:
Siřičitany kovů alkalických zemin se však zahříváním rozkládají na oxid siřičitý a příslušný oxid kovu:
- MgSO3 → MgO + SO2
Reference
- Sulfurous acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina siřičitá na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina siřičitá na Wikimedia Commons

