Diazosloučeniny
Diazosloučeniny jsou organické sloučeniny obsahující diazoskupinu (=N+=N−) vázanou na uhlíkový atom, obecný vzorec je R-(C=N2)-R'. Nejjednodušší takovou sloučeninou je diazomethan.
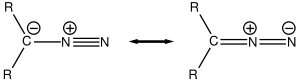
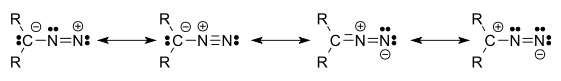
Elektronová struktura těchto sloučenin se skládá z kladného náboje na centrálním dusíkovém atomu a záporného náboje distribuovaného mezi koncovým dusíkem a uhlíkem, na nějž jsou tyto dusíky navázány. K nejstabilnějším diazosloučeninám patří α-diazo-ß-diketony a α-diazo-ß-diestery, a to díky delokalizaci záporného náboje v karbonylových skupinách; většina alkyldiazosloučenin patří mezi výbušniny.
Skupinou izomerních sloučenin, které však nemají mnoho podobných vlastností, jsou diaziriny, u nichž jsou uhlík a dva dusíky propojené v cyklickém řetězci.
Diazosloučeniny existují ve čtyřech rezonančních strukturách:[1]
Historie
První diazosloučeniny připravil roku 1858 německý chemik Peter Griess, když objevil novou všestrannou reakci.[2][3]
Příprava
Je známo několik laboratorních postupů na přípravu diazosloučenin.[4]
Z aminů
Alfa akceptory substituované primární alifatické aminy R-CH2-NH2 (R = COOR, CN, CHO, COR) reagují s kyselinou dusitou za vzniku diazosloučenin.
Z diazomethylových sloučenin
Příkladem elektrofilní substituce za použití diazomethylové sloučeniny je reakce acylhalogenidu s diazomethanem.[5], jenž je mimo jiné prvním krokem v Arndt-Eistertově syntéze.
Diazo přesunem
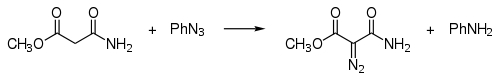
Přidiazo přesunu reagují některé karbonové kyseliny s tosylazidem:
Tato reakce se také nazývá Regitzův diazo přesun.[6] Dalšími příklady jsou syntéza terc-butyldiazoacetátu[7] a di-terc-butyldiazomalonátu.[8]
Z N-alkyl-N-nitrososloučenin
Diazosloučeniny lze získat eliminační reakcí N-alkyl-N-nitrososloučenin,[9] jako například při přípravě diazomethanu z diazaldu nebo MNNG:
Z hydrazonů
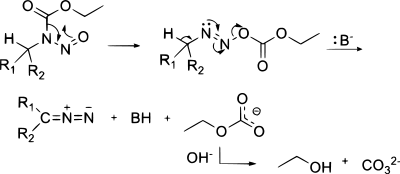
Diazosloučeniny se dají připravit také z hydrazonů. Hydrazony se oxidují (vlastně dehydrogenují), například oxidem stříbrným; příkladem může být příprava 2-diazopropanu z acetonhydrazonu.[10] Jako oxidační činidlo lze použít rovněž octan olovičitý, oxid manganičitý nebo Swernovo činidlo. Při syntéze krotyldiazoacetátu reagují tosylhydrazony (obecný vzorec RRC=N-NHTs) se zásadou jako je například triethylamin.[11]
Reakcí karbonylových sloučenin s derivátem hydrazinu 1,2-bis(terc-butyldimethylsilyl)hydrazinem vzniká hydrazom; ten se následně působením difluorjodbenzenu mění na diazosloučeninu:[12][13]
Příprava fragmentací
1,3-disubstituované alkylaryltriazeny mohou být fragmentovány za tvorby diazosloučenin. Tyto triazeny (ArN=NNH-CH2R) lze připravit spárováním diazoniových solí s primárními aminy.
Reakce
Cykloadice
Diazosloučeniny se využívají k diazoalkanovým 1,3-dipolárním cykloadicím, kde reagují jako 1,3-dipóly.
Tvorba karbenů
Diazosloučeniny se používají jako prekurzory karbenů, jenžt se získávají jejich termolýzou a nebo fotolýzou, například ve Wolffově přesmyku. Některé se mohou spárovat a vytvořit alkeny karbenovou dimerizací.
Diazosloučeniny jsou meziprodukty Bamfordovy-Stevensovy reakce, při níž se přeměňují tosylhydrazony na alkeny, i zde vzniká karbenový meziprodukt:
Jako nukleofily
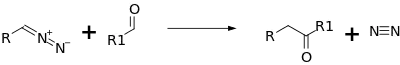
Buchnerovou-Curtiusovou-Schlotterbeckovou reakcí se utváří ketony z aldehydů a alifatických diazosloučenin:
Tato reakce patří mezi nukleofilní adice.
Ostatní
V Doyleově-Kirmseově reakci reagují určité diazosloučeniny s allylsulfidy za vzniku homoallylsulfidů.
Diazosloučeniny se také používají při cyklopropanacích, například při reakci ethyldiazoacetátu se styrenem.[15]
Vnitromolekulárními reakcemi diazokarbonylových sloučenin vznikají cyklopropany. Při Buchnerově rozšíření cyklu reagují diazosloučeniny s aromatickými cykly, přičemž se tyto cykly rozšiřují.
Výskyt v přírodě
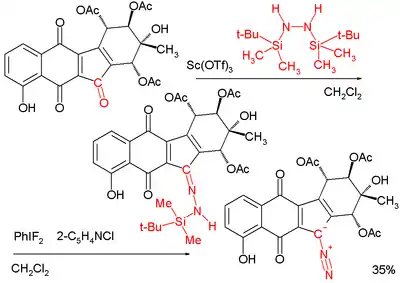
Diazoskupinu obsahují dvě skupiny přírodních sloučenin: kinamycin a lomaiviticin. Tyto látky fungují jako DNA interkalátory. Reduktivně indukovanou ztrátou N2 dochází ke vzniku fluorenylového radikálu, který štěpí DNA.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Diazosloučeniny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Diazosloučeniny na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Diazo na anglické Wikipedii.
- F.A. Carey R.J. Sundberg Advanced Organic Chemistry, 2nd Edition
- Trevor I. Williams, ‘Griess, (Johann) Peter (1829–1888)’, Oxford Dictionary of National Biography, Oxford University Press, 2004
- Peter Griess (1858) "Vorläufige Notiz über die Einwirkung von salpetriger Säure auf Amidinitro- und Aminitrophenylsäure," (Preliminary notice of the reaction of nitrous acid with picramic acid and aminonitrophenol), Annalen der Chemie und Pharmacie, 106 : 123-125.
- New Syntheses of Diazo Compounds Gerhard Maas Angew. Chem. Int. Ed. 2009, 48, 8186 – 8195 DOI:10.1002/anie.200902785
- Example Organic Syntheses, Coll. Vol. 3, p.119 (1955); Vol. 26, p.13 (1946).Link
- M. Regitz, Angew. Chem., 79, 786 (1967); Angew. Chem. Intern. Ed. Engl., 6, 733 (1967).
- Organic Syntheses, Coll. Vol. 5, p.179 (1973); Vol. 48, p.36 (1968). Link Archivováno 30. 9. 2012 na Wayback Machine
- Organic Syntheses, Coll. Vol. 6, p.414 (1988); Vol. 59, p.66 (1979). Link Archivováno 30. 9. 2012 na Wayback Machine
- Example: Organic Syntheses, Coll. Vol. 6, p.981 (1988); Vol. 57, p.95 (1977). Link
- Organic Syntheses, Coll. Vol. 6, p.392 (1988); Vol. 50, p.27 (1970). Link
- Organic Syntheses, Coll. Vol. 5, p.258 (1973); Vol. 49, p.22 (1969). Link Archivováno 2. 10. 2012 na Wayback Machine
- LEI, X.; PORCO JA, J. Total synthesis of the diazobenzofluorene antibiotic (-)-kinamycin C1. Journal of the American Chemical Society. 2006, s. 14790–14791. DOI 10.1021/ja066621v. PMID 17105273. (anglicky)
- Elusive Natural Product Is Synthesized Stu Borman Chemical & Engineering News October 31, 2006 Link Archivováno 28. 8. 2008 na Wayback Machine.
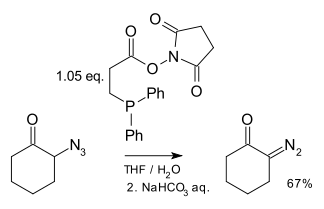
- A Phosphine-Mediated Conversion of Azides into Diazo Compounds Eddie L. Myers and Ronald T. Raines Angew. Chem. Int. Ed. 2009, 48, 2359 –2363 DOI:10.1002/anie.200804689
- Organic Syntheses, Coll. Vol. 6, p.913 (1988); Vol. 50, p.94 (1970).Link Archivováno 2. 10. 2012 na Wayback Machine