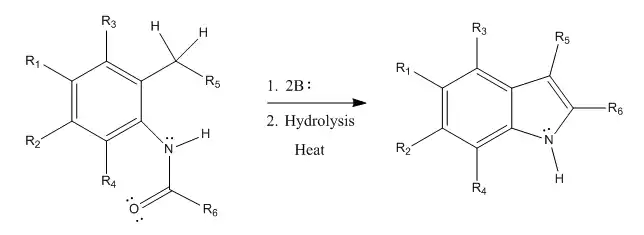
Madelungova syntéza indolů
Madelungova syntéza indolů je organická reakce sloužící k přípravě a výrobě substituovaných či nesubstituovaných indolů vnitromolekulární cyklizací N-fenylamidů za použití silné zásady při vysokých teplotách. Poprvé ji popsal Walter Madelung v roce 1912, když připravil 2-fenylindol z N-benzoyl-o-toluidinu a dvou ekvivalentů ethoxidu sodného zahříváním za nepřístupu vzduchu. Obvykle se k této reakci používá sodný nebo draselný alkoxid rozpuštěný v hexanu nebo tetrahydrofuranu a reakční teplota bývá 200–400 °C. K provedení syntézy je také nutná hydrolýza. Madelungova cyklizace je velmi významná, jelikož je jedním z mála známých postupů přípravy indolů zásaditě katalyzovanými cyklizacemi N-benzoyl-o-toluidinů.
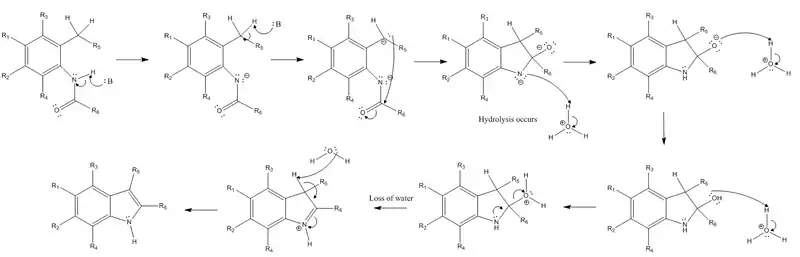
Mechanismus
Reakce začíná odštěpením vodíkového iontu z amidové skupiny a z benzylové skupiny v poloze ortho vůči amidovému substituentu pomocí silné zásady. Takto vytvořený karboanion následně nukleofilně reaguje s elektrofilním karbonylovým uhlíkem amidu. Tímto se vazba pí v molekule amidu přemění na volný elektronový pár, čímž získá atom kyslíku záporný náboj. Poté již není zásada potřeba a probíhá především hydrolýza. Záporně nabitý dusík je protonován a stává se znovu neutrálním; kyslík je dvakrát protonován, čímž získává kladný náboj a stává se tak dobrou odcházející skupinou. Volný pár elektronů na dusíku vytvoří vazbu pí, což vede k odštěpení kladně nabité odcházející skupiny a vytvoření kladného náboje na dusíku. Posledním krokem je eliminace (konkrétně E2 reakce), při které dojde k odštěpení dalšího, původně benzylového, vodíku a následně se vytvoří bicyklická molekula, jejíž elektrony vytvořily novou vazbu pí v cyklu. Díky tomu se vazba pí vytvořená dusíkem v předchozím kroku přemění zpět na volný elektronový pár, čímž se obnoví neutralita dusíkového atomu.
Úpravy podmínek reakce
Bylo vyvinuto několik postupů zvyšujících výtěžnost Madelungovy syntézy. Výtěžnost bývá vyšší, pokud je na aromatické jádro navázána skupina dodávající elektrony, a nižší, když je na něj navázána skupina odtahující elektrony.[1] Jestliže je však substituent odtahující elektrony na pozici R5, tak se výtěžnost zvyšuje. Účinnost reakce také výrazně závisí na velikosti substituentu na pozici R6; čím je tento substituent mohutnější, tím je reakce méně účinná. Madelungova syntéza se provádí za poměrně tvrdých podmínek. Byly však objeveny její obměny, při kterých jsou potřebné teploty nižší a reakce má stále dobrou výtěžnost. Například při napojení skupiny dodávající elektrony na aromatické jádro a skupiny odtahující elektrony do polohy R5 se potřebná teplota snižuje na asi 25 °C.[1] Při použití butyllithia nebo diisopropylamidu lithného jako zásady a tetrahydrofuranu jako rozpouštědla lze reakci účinně dokonce při −20 – 25 °C.[2] Tato pozměněná Madelungova syntéza bývá označována jako Madelungova-Houlihanova varianta.[3]
Využití
Madelungova syntéza se často používá v průmyslu, například na výrobu indolového alkaloidu (-)-penitremu D, látky vytvářené paličkovicí nachovou a způsobující onemocnění svalů i nervů u hospodářských zvířat.[4] Jelikož může tento toxin způsobovat značné škody v živočišné výrobě, tak je třeba znát možnosti jeho přípravy a rychlého rozkladu.
-Penitrem_D.png.webp)
Madelungova syntéza se také využívá při přípravě 2,6-difenyl-1,5-diaza-1,5-dihydro-s-indacenu z 2,5-dimethyl-1,4-fenylendiaminu.[5]
Jako zásada se zde používá ethoxid sodný a reakce se provádí při 320 až 330 °C. Produkt lze použít na výrobu organických světelných diod, které mohou mít mnoho různých využití v průmyslu.
Smithova varianta
Smithovu variantu Madelungovy syntézy indolů, také označovanou jako Smithova syntéza indolů, objevil v roce 1986 Amos Smith. Spočívá v kondenzaci organolithných sloučenin odvozených od 2-alkyl-N-trimethylsilylanilinu s karboxylovými kyselinami nebo jejich estery za tvorby substituovaných indolů.[6] Lze při ní použít široké spektrum různých anilinů, substituovaných například alkylovými, methoxy a halogenidovými skupinami, které mohou reagovat s neenolizovatelnými estery nebo laktony za tvorby N-lithioketaminových meziproduktů. U těchto meziproduktů probíhají vnitromolekulární Petersonovy olefinace, kterými vznikají indolininy, které následně tautomerizují na 2-substituované indoly. Smithova syntéza indolů patří mezi nejvýznamnější obměny Madelungovy syntézy.
Mechamismus
Na začátku Smithovy syntézy je pomocí dvou ekvivalentů organolithné sloučeniny deprotonován alkylový substituent i dusík, což vede k vytvoření záporných nábojů. Vzniklý karboanion reaguje s karbonylovým uhlíkem esteru, vazba pí u elektrofilu se tím mění na volný elektronový pár na kyslíku. Následně dojde k obnovení vazby pí a odštěpení skupiny -OR. Poté záporně nabitý dusík nukleofilně reaguje se sousedním karbonylovým uhlíkem, čímž se znovu vytvoří volný elektronový pár. Kyslík, na kterém se vytvoří záporný náboj, poté reaguje s atomem křemíku v trimethylsilylové skupině, čímž vzniká tricyklická sloučenina, kladně nabitý atom křemíku a neutrální atom kyslíku. Součástí této syntézy je vnitromolekulární Petersonova olefinace na heteroatomu, která vede k odštěpení trimethylsilylové skupiny a tvorbě vazby pí v pětičlenném cyklu obsahujícím atom dusíku. Takto vytvořená molekula se následně tautomerizuje na výsledný produkt.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Madelungova syntéza indolů na Wikimedia Commons
Obrázky, zvuky či videa k tématu Madelungova syntéza indolů na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Madelung synthesis na anglické Wikipedii.
- Laszlo Kurti; Barbara Czako. Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press, 2005. ISBN 0-12-429785-4. S. 270.
- William Houlihan; Uike Parrino. Lithiation of N-(2-Alkylphenyl)alkanamides and Related Compounds. A Modified Madelung Indole Synthesis. Journal of Organic Chemistry. 1981-05-07, s. 4511–4515. DOI 10.1021/jo00335a038.
- Gordon Gribble. Recent developments in indole ring synthesis—methodology and applications. Journal of the Chemical Society, Perkin Transactions 1. 2000-03-23, s. 5. DOI 10.1039/A909834H.
- Amos Smith; Ishiyama Kanoh; Rainier Minakawa; Moser Cui. Tremorgenic Indole Alkaloids. The Total Synthesis of (-)-Penitrem D. Journal of the American Chemical Society. 2003-07-09, s. 8828–8837. DOI 10.1021/ja034842k. PMID 12837093.
- Xu Jin; Desseyn Peng; Heremans Janssens. Synthesis, optical and electroluminescent properties of a novel Indacene. Synthetic Metals. 2003-09-02, s. 529–534. DOI 10.1016/S0379-6779(03)00338-2.
- SMITH, Amos; VISNICK; HASELTINE; SPRENGELER. Organometallic Reagents in Synthesis: A New Protocol for Construction of the Indole Nucleus. Tetrahedron. 1986, s. 2957–2969. DOI 10.1016/S0040-4020(01)90586-1. (anglicky)