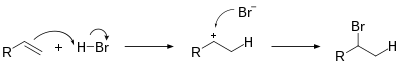
Hydrohalogenace
Hydrohalogenace je elektrofilní adice halogenovodíkových kyselin na alkeny za vzniku odpovídajících halogenalkanů.[1][2][3]
Pokud je na každý atom vodíku, z nichž vychází dvojná vazba, napojen různý počet atomů vodíku, tak se halogen přednostně navazuje na uhlík s méně vodíkovými substituenty, tento jev se nazývá Markovnikovovo pravidlo. Jeho příčinou je tvorba stabilnějšího karbokationtu z alkenu a kyseliny (HX) (stabilita klesá v řadě: terciární > sekundární > primární > methyl) vedle aniontu halogenu.
Jako příklad hydrochlorace lze uvést reakci indenu s chlorovodíkem:[4]
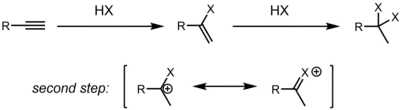
Do hydrohalogenací mohou také vstoupit alkyny. V závislosti na substrátu mohou jejich hydrohalogenace probíhat jako soustředěné protonace/nukleofilní ataky (AdE3) nebo postupně tak, že se nejprve protonuje alkyn za vzniku vinylového kationtu a poté nastane atak HX/X− za vzniku produktu (AdE2).[5]
U alkynů má na regioselektivitu vliv relativní stabilita uhlíkových atomů stabilizující kladný náboj (částečný u soustředěných přechodných stavů a úplný u vinylových kationtů). V závislosti na podmínkách reakce může vznikat alkenylhalogenid nebo produkt dvojnásobné hydrohalogenace, dihalogenalkan. Ve většině případů se přitom vytvářejí gem-dihalogenalkany.[6] Regioselektivita se dá vysvětlit rezonanční stabilizací sousedního karbokationtu volným elektronovým párem původně navázaného halogenu. Zastavit substituci v prvním kroku může být obtížné a často vznikají směsi mono- a dihydrohalogenovaných sloučenin.
Protimarkovnikovovská adice
Za přítomnosti organických peroxidů se HBr aduje na alkeny protimarkovnikovovsky.[7] Tato regiochemie vyplývá z mechanismu reakce, který upřednostňuje tvorbu stálejšího radikálového meziproduktu (stabilita klesá v řadě: terciární > sekundární > primární > methyl). Mechanismus je zde podobný jako u řetězových reakcí, jako jsou radikálové halogenace, kde peroxid podporuje vytváření bromidových radikálů. Za přítomnosti peroxidů se tak HBr aduje způsobem, kdy je atom bromu na uhlík s nejvíce vodíkovými substituenty a vodík na ten, který má navázaných vodíků nejméně. Tento proces je ovšem omezen pouze na adice HBr.
Ostatní halogenovodíky (HF, HCl, HI) se nechovají tímto způsobem. Vazba vodík-fluor je příliš silná a tak se netvoří fluoridové radikály. Chlorovodík reaguje příliš pomalu, protože vazba vodík-chlor je také silná. V důsledku nízké energie vazby vodík-jod se při reakci neuvolňuje dostatek tepla.
Vzniklé 1-bromalkany jsou užitečnými alkylačními činidly. V reakcích s dimethylaminem slouží jako prekurzory mastných aminů. Alkylbromidy s dlouhými řetězci, například 1-bromdodekan, reakcemi s terciárními aminy vytváří kvartérní amoniové soli, sloužící jako katalyzátory fázového přenosu.[8]
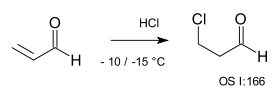
Za přítomnosti Michaelových akceptorů reakce také probíhá protimarkovnikovsky, protože nukleofil X− vstupuje do nukleofilní adice; příkladem může být reakce HCl s akroleinem.[9]
Reference
V tomto článku byl použit překlad textu z článku Hydrohalogenation na anglické Wikipedii.
- T. W. Graham Solomons; Craig B. Fryhle. Organic Chemistry. [s.l.]: [s.n.], 2003. Dostupné online. ISBN 0-471-41799-8.
- Janice G. Smith. Organic Chemistry. [s.l.]: McGraw-Hill, 2007. ISBN 0-07-332749-2.
- P. J. Kropp; K. A. Dans; S. D. Crawford; M. W. Tubergen; K. D. Kepler; S. L. Craig; V. P. Wilson. Surface-mediated reactions. 1. Hydrohalogenation of alkenes and alkynes. Journal of the American Chemical Society. 1990, s. 7433–7434. DOI 10.1021/ja00176a075.
- R. A. PACAUD; C. F. H. ALLEN. α-Hydroindone. Org. Synth.. Dostupné online. (anglicky); Coll. Vol.. S. 336. (anglicky)
- Thomas H. Lowry. Mechanism and theory in organic chemistry. [s.l.]: Harper & Row, 1987. Dostupné online. ISBN 0-06-044084-8.
- K. Vollhardt; C. Peter. Organic chemistry : structure and function. [s.l.]: [s.n.] Dostupné online. ISBN 978-1-4641-2027-5.
- March Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- Šablona:Ullmann
- C. MOUREU; R. CHAUX. β-Chloropropionic acid. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 166. (anglicky)