Radikálová halogenace
Radikálová halogenace je v organické chemii taková halogenační reakce, která probíhá radikálovým mechanismem; patří tedy mezi radikálové substituce. Obvykle probíhá u alkanů a alkylovaných arenů, k tvorbě radikálů se nejčastěji využívá ultrafialové záření. Radikálovou halogenací se vyrábí například chloroform, dichlormethan a hexachlorbutadien.
Mechanismus
Mechanismus radikálové halogenace je zde znázorněn pro chloraci methanu:
1. Iniciace: Dojde k homolytickému rozštěpení molekuly chloru na dva atomy, energii obvykle dodává ultrafialové záření.

2. Propagace - probíhá ve dvou krocích, v prvním se z molekuly methanu odštěpí vodík a vznikne methylový radikál, který následně reaguje s Cl2, což vede ke vzniku radikálů chloru.
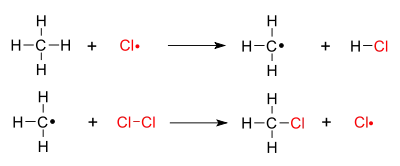
Tímto se vytvoří chlorovaný produkt a další radikál, který se následně účastní dalších propagačních reakcí. Je-li přítomno dostatečné množství chloru, vytvářejí se také vícenásobně chlorované produkty jako je CH2Cl2.
3. Terminace - dva radikály se spojí a vytvoří tak neutrální molekulu:
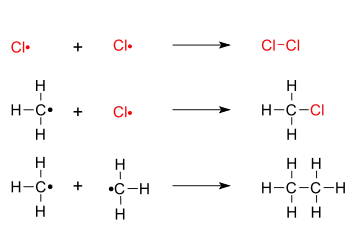
V této části se mohou vytvořit molekuly s větším počtem uhlíkových atomů než měl původní reaktant.
Celá reakce probíhá podle této rovnice:

U methanu a ethanu je u všech atomů vodíku stejná pravděpodobnost, že budou nahrazeny halogenem, což vede ke statistickému rozdělení produktů. U vyšších alkanů, jako je například propan, k halogenaci přednostně dochází na atomech uhlíku, na které je původně navázáno méně vodíkových atomů.
Relativní rychlosti reakcí různých halogenů klesají v řadě fluor (108) > chlor (1) > brom (7 × 10−11) > jod (2 × 10−22). Při fluoraci je tak obtížné ovlivňovat tvorbu konkrétních produktů, chlorace probíhají stále poměrně rychle, bromace jsou pomalé a je při nich potřeba silnější ozáření ultrafialovým zářením a jodace prakticky neprobíhají a jsou termodynamicky nevýhodné.
V organické syntéze se často provádí Wohlova–Zieglerova reakce s použitím N-bromsukcinimidu, která je alternativou radikálové bromace.
Možnosti ovlivnění produktů
- Při halogenaci obvykle nedochází pouze k monosubstituci, ale v závislosti na podmínkách reakce mohou například chlorací methanu vznikat kromě chlormethanu i dichlormethan, trichlormethan a tetrachlormethan.
- Z uhlovodíků s více než dvěma uhlíkovými atomy mohou i monochlorací vznikat různé produkty, například u n-butanu se při substituci do polohy 1 tvoří 1-chlorbutan (CH3−CH2−CH2−CH2Cl) a při substituci do polohy 2 vzniká 2-chlorbutan (CH3−CH2−CHCl−CH3). Zastoupení jednotlivých produktů záleží na rychlostech jednotlivých substitucí; u butanu probíhá rychleji substituce do polohy 2 a proto vzniká 2-chlorbutan ve větším množství než 1-chlorbutan.
- Chlorace je většinou méně selektivní než bromace. Fluorace je nejen méně selektivní než chlorace, ale také značně exotermní a musí se provádět opatrně, aby nedošlo k výbuchu. Radikál bromu je málo reaktivní a příslušný meziprodukt vzniká pomaleji a má více radikálový charakter než meziprodukt chlorační reakce.
- Větší selektivitu bromace lze také vysvětlit pomocí vazebných energií. K rozštěpení vazby C-H atomem bromu je třeba dodat 397 kJ/mol. Vazba C-Br má energii 366 kJ/mol, rozdíl těchto energií je +31 kJ/mol, reakce je tedy endotermická a reaktanty jsou stabilnější než produkty. Vazba C-Cl má energii 431 kJ/mol a změna entalpie je tak 397-431, tedy -34 kJ/mol a reakce je exotermní. Z tohoto důvodu bromace převažuje nad tvorbou nejstabilnějšího (terciárního) radikálu a tak selektivnější. Ke vzniku vazby H-Br a terciárního radikálu je totiž potřeba +14 kJ/mol, což je o 17 kJ/mol méně, než u sekundárního radikálu. Jod nevstupuje do radikálových halogenací, protože je celý proces endotermický.
- Zastoupení produktů monochlorace alkanů s více než dvěma uhlíky lze předvídat.[1][2] Experimentálně bylo zjištěno, že poměr rychlostí chlorace do primárních, sekundárních a terciárních poloh je 1:3,8:5, což odpovídá tomu, že terciární radikály jsou stabilnější než sekundární a sekundární jsou zase stabilnější než primární. Podle tohoto lze zastoupení jednotlivých produktů předvídat s velkou přesností.
Radikálové fluorace, chlorace a bromace obvykle probíhají podle těchto pravidel:
- Uhlovodíky s jedním nebo více arylovými substituenty reagují rychleji než uhlovodíky s třemi alkylovými substituenty (terciární), ty reagují rychleji než sekundární a sekundární reagují rychleji než primární.
Níže je zobrazena radikálová bromace toluenu:[3]
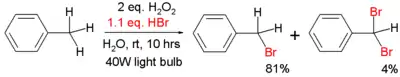
Reakce probíhá ve vodě místo organického rozpouštědla a potřebný brom se získává oxidací kyseliny bromovodíkové peroxidem vodíku.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Free-radical halogenation na anglické Wikipedii.
- Carey, F.A. Organic Chemistry, Sixth Edition. New York, NY: McGraw Hill. 2006.
- Peters, W. Chemistry 3421 Lecture Notes. University of Colorado, Denver. Radical Halogenation, Fall 2006.
- Free radical bromination by the H2O2–HBr system on water Ajda Podgoršek, Stojan Stavber, Marko Zupana, and Jernej Iskraa Tetrahedron Letters 47 (2006) 7245–7247 DOI:10.1016/j.tetlet.2006.07.109