Alan (chemie)
Alan (také nazývaný hydrid hlinitý nebo aluman) je anorganická sloučenina se vzorcem AlH3. V čistém stavu jde o bílou pevnou látku, vzorky však mohou být našedlé v důsledku přítomnosti nečistot a snižování velikosti částic. V závislosti na podmínkách přípravy může být povrch této látky pasivován tenkou vrstvou oxidu a/nebo hydroxidu hlinitého. Alan a jeho deriváty se používají v organické syntéze jako redukční činidla.[2]
| Alan | |
|---|---|
Model struktury | |
| Obecné | |
| Systematický název | alan |
| Ostatní názvy | hydrid hlinitý |
| Sumární vzorec | AlH3 |
| Vzhled | bezbarvá až bílá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 7784-21-6 |
| EC-no (EINECS/ELINCS/NLP) | 232-053-2 |
| PubChem | 14488 |
| ChEBI | 30136 |
| SMILES | [AlH3] |
| InChI | 1S/Al.3H |
| Vlastnosti | |
| Molární hmotnost | 30,005 g/mol |
| Teplota tání | 150 °C (423 K) (rozklad od 105 °C) |
| Hustota | 1,477 g/cm3[1] |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech |
reaguje s ethanolem |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −11,4 kJ/mol |
| Standardní molární entropie S° | 30 J⋅K−1⋅mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 46,4 kJ/mol |
| Bezpečnost | |
| [1] | |
| H-věty | H260 H314[1] |
| P-věty | P223 P231+232 P260 P264 P280 P301+330+331 P303+361+353 P304+340 P305+351+338 P310 P321 P335+334 P363 P370+378 P402+404 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
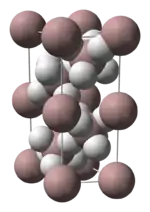
Struktura
Alan vytváří polymer, někdy se tak pro něj používá vzorec (AlH3)n. Vyskytuje se v různých polymorfech, označovaných α-alan, α’-alan, β-alan, γ-alan, δ-alan, ε-alan a ζ-alan. α-Alan se vyskytuje v podobě krychlí, α’-alan vytváří jehlicovité krystaly a γ-alan shluky jehlic. Alan se rozpouští v tetrahydrofuranu (THF) a diethyletheru. Rychlost krystalizace pevného alanu z etheru závisí na způsobu přípravy.[3]
Krystalová struktura α-alanu se skládá z atomů hliníku obklopených 6 atomy vodíku a spojenými s dalšími 6 atomy hliníku. Vzdálenosti Al-H jslou stejné (172 pm) a úhly Al-H-Al činí 141°.[4]
 |  |  |
| jednotková buňka α-AlH3 | koordinace Al | koordinace H |
α-Alan je ze všech polymorfů tepelně nejstálejší. β-alan a γ-alan vznikají společně a zahříváním se mění na α-alan. δ-, ε- a θ-alan se tvoří za odlišných podmínek. I když jsou méně tepelně stálé, tak se δ, ε a θ polymorfy po zahřátí nepřeměňují na α-alan.[3]
Příprava
Hydridy hliníku a jejich komplexy jsou známy dlouhou dobu.[8] První příprava alanu byla popsána v roce 1947 a v roce 1999 byl na ní získán patent.[9][10] Hydrid hlinitý se připravuje reakcí hydridu lithnohlinitého s chloridem hlinitým;[11] v průběhu syntézy se tvoří chlorid lithný, který je třeba odstraňovat:
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
Etherový roztok alanu je třeba ihned použít, protože dochází k rychlému srážení polymeru; roztoky hydridu hlinitého se po třech dnech rozkládají. Hydrid hlinitý je reaktivnější než hydrid lithnohlinitý, LiAlH4.[3]
Je známo několik dalších způsobů přípravy:
- 2 LiAlH4 + BeCl2 → 2 AlH3 + Li2BeH2Cl2
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
- 2 LiAlH4 + I2 → 2 AlH3 + 2 LiI + H2
Electrochemická syntéza
Alan lze také vytvořit elektrochemicky;[12][13][14][15] k čemuž bylo vyvinuto několik postupů.[16][17] Elektrochemicky připravený alan neobsahuje pozůstatky chloridů. Tvorba alanu v Clasenových elektrochemických článcích obsahujících tetrahydrofuran jako rozpouštědlo, tetrahydridohlinitan sodný jako elektrolyt, hliníkovou anodu a železný drát potopený do rtuti, má dva možné navržené mechanismy. Sodík vytvoří se rtutí amalgám, který brání tvorbě vedlejších produktů, vodík vzniklý první reakcí je tak zachycen a reaguje s amalgámem za vzniku hydridu sodného. Při Clasenově přípravě nedochází ke ztrátě výchozího materiálu.
Při použití nerozpustné anody bude reakce probíhat podle rovnice 1, u rozpustné podle rovnice 2:
- AlH4− − e− → AlH3 · nTHF + Šablona:FracH2
- 3AlH4− + Al − 3e− → 4AlH3 · nTHF
U reakce 2 se anoda spotřebovává, což omezuje množství hydridu, které lze získat s daným článkem.
Hydrogenace hliníku za vysokého tlaku
α-AlH3 může být připraven hydrogenací hliníku při 10 GPa a 600 °C. Reakcí zkapalněného vodíku se tvoří α-AlH3, který může být obnoven za běžných podmínek.[18]
Reakce
Tvorba aduktů s Lewisovými zásadami
AlH3 vytváří adukty se silnými Lewisovými zásadami, může například reagovat s trimethylaminem za vzniku 1:1 i 1:2 komplexu. 1:1 komplex je v plynném skupenství tetraedrický, zatímco jako pevná látka tvoří dimer s můstkovými atomy vodíku, (NMe3Al(μ-H))2.[19]
1:2 komplex má trigonálně bipyramidovou strukturu. Některé adukty, například dimethylethylaminalan, NMe2Et · AlH3, se teplem rozkládají na hliník a mohou být využity v MOCVD.[20]
Komplex alanu s diethyletherem vzniká podle této rovnice:
- AlH3 + (C2H5)2O → H3Al · O(C2H5)2
Reakcí s hydridem lithným v etheru se vytváří hydrid lithno-hlinitý:
- AlH3 + LiH → LiAlH4
Redukce funkčních skupin
Hydrid hlinitý se nejčastěji používá k redukcím různých funkčních skupin.[21]
Reakce hydridu hlinitého se v mnohém podobají těm, které vykazuje hydrid lithno-hlinitý; mimo jiné redukuje aldehydy, ketony, karboxylové kyseliny a jejich anhydridy, acylchloridy, estery a laktony na příslušné alkoholy. Amidy, nitrily a oximy se reakcemi s AlH3 mění na aminy.
Ohledně selektivity funkčních skupin se alan liší od ostatních hydridů, například v následující redukci cyklohexanonu dával hydrid lithnohlinitý trans a cis produkt v poměru 1,9:1, zatímco u hydridu hlinitého poměr trans:cis činil 7,3 : 1.[22]
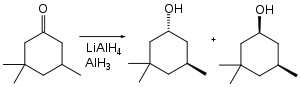
Alan umožňuje provádět hydroxymethylace některých ketonů.[23] Samotné ketony se neredukují, protože jsou chráněny jako enoláty.
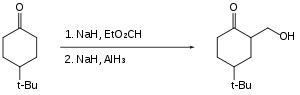
Organohalogenidy se hydridem hlinitým neredukují vůbec nebo jen pomalu, přítomností halogenových substituentů tak lze umožnit redukce reaktivních funkčních skupin, jako jsou karboxylové kyseliny.[24]
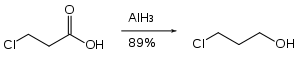
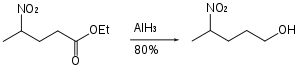
Nitroskupiny hydrid hlinitý neredukuje, takže může být použit na redukce esterů. které je obsahují.[25]
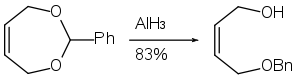
Hydridem hlinitým lze zredukovat acetaly na částečně chráněné dioly.[26]
Alan se též může účastnit otevírání kruhů epoxidů.[27]

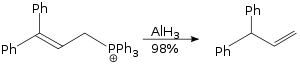
Allylové přesmyky za přítomnosti AlH3 probíhají SN2 mechanismem a nejsou závislé na sterických vlastnostech reaktantů.[28]
AH3 reaguje po zahřátí i s oxidem uhličitým, vzniká přitom methan:
- 4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
Hydroaluminace
Hydrid hlinitý reaguje s propargylalkoholy.[29] Za přítomnosti chloridu titaničitého se se může navázat na dvojné vazby;[30] tato reakce je podobná hydroboraci.
Bezpečnost
Alan není hořlavý sám o sobě. Skladován by měl být podobně jako ostatní hydridová redukční činidla, jakým je například hydrid lithnohlinitý. Rozkládá se při styku se vzduchem a vodou, i když pasivace tento rozklad výrazně zpomaluje.[31]
Redukce trifluormethylových sloučenin alanem může probíhat explozivně.[32]
Reference
V tomto článku byl použit překlad textu z článku Aluminium hydride na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/14488
- H. C. Brown; S. Krishnamurthy. Forty Years of Hydride Reductions. Tetrahedron. 1979, s. 567–607. DOI 10.1016/0040-4020(79)87003-9.
- Šablona:Cite patent
- J. W. Turley; H. F. Rinn. The Crystal Structure of Aluminum Hydride. Inorganic Chemistry. 1969, s. 18–22. DOI 10.1021/ic50071a005.
- F. A. Kurth; R. A. Eberlein; H.-G. Schnöckel; A. J. Downs; C. R. Pulham. Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations. Journal of the Chemical Society, Chemical Communications. 1993, s. 1302–1304. DOI 10.1039/C39930001302.
- L. Andrews; X. Wang. The Infrared Spectrum of Al2H6 in Solid Hydrogen. Science. 2003, s. 2049–2052. DOI 10.1126/science.1082456. PMID 12663923. Bibcode 2003Sci...299.2049A.
- C. R. Pulham; A. J. Downs; M. J. Goode; D. W. H. Rankin; H. E. Robertson. Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction. Journal of the American Chemical Society. 1991, s. 5149–5162. DOI 10.1021/ja00014a003.
- F. M. Brower; N. E. Matzek; P. F. Reigler; H. W. Rinn; D. L. Schmidt; J. A. Snover; K. Terada. Preparation and Properties of Aluminum Hydride. Journal of the American Chemical Society. 1976, s. 2450–2454. DOI 10.1021/ja00425a011.
- A. E. Finholt; A. C. Bond; H. I. Schlesinger. Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry. Journal of the American Chemical Society. 1947, s. 1199–1203. DOI 10.1021/ja01197a061.
- Šablona:Cite patent
- D. L. Schmidt; C. B. Roberts; P. F. Reigler; M. F. Lemanski; E. P. Schram. Aluminum Trihydride-Diethyl Etherate: (Etherated Alane). Inorganic Syntheses. 1973, s. 47–52. ISBN 9780470132456. DOI 10.1002/9780470132456.ch10.
- N. M. Alpatova; T. N. Dymova; Yu. Kessler; O. R. Osipov. Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride. Russian Chemical Reviews. 1968, s. 99–114. DOI 10.1070/RC1968v037n02ABEH001617. Bibcode 1968RuCRv..37...99A.
- K. N. Semenenko; B. M. Bulychev; E. A. Shevlyagina. Aluminium Hydride. Russian Chemical Reviews. 1966, s. 649–658. DOI 10.1070/RC1966v035n09ABEH001513. Bibcode 1966RuCRv..35..649S.
- R. Zidan; B. L. Garcia-Diaz; C. S. Fewox; A. C. Stowe; J. R. Gray; A. G. Harter. Aluminium hydride: a reversible material for hydrogen storage. Chemical Communications. 2009, s. 3717–3719. Dostupné online. DOI 10.1039/B901878F. PMID 19557259.
- M. J. Martinez-Rodriguez; B. L. Garcia-Diaz; J. A. Teprovich; D. A. Knight; R. Zidan. Aluminium hydride: a reversible material for hydrogen storage. Advances in the electrochemical regeneration of aluminum hydride. 2012, s. 545–550. DOI 10.1007/s00339-011-6647-y. Bibcode 2012ApPhA.106..545M.
- Šablona:Cite patent
- Šablona:Cite patent
- H. Saitoh; Y. Sakurai; A. Machida; Y. Katayama; K. Aoki. In situX-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3. Journal of Physics: Conference Series. 2010, s. 012127. ISSN 1742-6596. DOI 10.1088/1742-6596/215/1/012127. Bibcode 2010JPhCS.215a2127S.
- J. L. Atwood; F. R. Bennett; F. M. Elms; C. Jones; C. L. Raston; K. D. Robinson. Tertiary Amine Stabilized Dialane. Journal of the American Chemical Society. 1991, s. 8183–8185. DOI 10.1021/ja00021a063.
- J.-H. Yun; B.-Y. Kim; S.-W. Rhee. Metal-Organic Chemical Vapor Deposition of Aluminum from Dimethylethylamine Alane. Thin Solid Films. 1998, s. 259–263. DOI 10.1016/S0040-6090(97)00333-7. Bibcode 1998TSF...312..259Y.
- P. Galatsis. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. ISBN 978-0-470-84289-8. DOI 10.1002/047084289X.rd245. Kapitola Diisobutylaluminum Hydride.
- D. C. Ayres; R. Sawdaye. The Stereoselective Reduction of Ketones by Aluminium Hydride. Journal of the Chemical Society B. 1967, s. 581–583. DOI 10.1039/J29670000581.
- E. J. Corey; D. E. Cane. Controlled Hydroxymethylation of Ketones. Journal of Organic Chemistry. 1971, s. 3070. DOI 10.1021/jo00819a047.
- Margaret J. Jorgenson. Selective reductions with aluminum hydride. Tetrahedron Letters. 1962, s. 559–562. DOI 10.1016/S0040-4039(00)76929-2.
- S. Takano; M. Akiyama; S. Sato; K. Ogasawara. A Facile Cleavage of Benzylidene Acetals with Diisobutylaluminum Hydride. Chemistry Letters. 1983, s. 1593–1596. Dostupné online. DOI 10.1246/cl.1983.1593.
- W. J. Richter. Asymmetric Synthesis at Prochiral Centers: Substituted 1,3-Dioxolanes. Journal of Organic Chemistry. 1981, s. 5119–5124. DOI 10.1021/jo00338a011.
- K. Maruoka; S. Saito; T. Ooi; H. Yamamoto. Selective Reduction of Methylenecycloalkane Oxides with 4-Substituted Diisobutylaluminum 2,6-Di-tert-butylphenoxides. Synlett. 1991, s. 255–256. DOI 10.1055/s-1991-20698.
- A. Claesson; L.-I. Olsson. Allenes and Acetylenes. 22. Mechanistic Aspects of the Allene-Forming Reductions (SN2' Reaction) of Chiral Propargylic Derivatives with Hydride Reagents. Journal of the American Chemical Society. 1979, s. 7302–7311. DOI 10.1021/ja00518a028.
- E. J. Corey; J. A. Katzenellenbogen; G. H. Posner. New Stereospecific Synthesis of Trisubstituted Olefins. Stereospecific Synthesis of Farnesol. Journal of the American Chemical Society. 1967, s. 4245–4247. DOI 10.1021/ja00992a065.
- F. Sato; S. Sato; H. Kodama; M. Sato. Reactions of Lithium Aluminum Hydride or Alane with Olefins Catalyzed by Titanium Tetrachloride or Zirconium Tetrachloride. A Convenient Route to Alkanes, 1-Haloalkanes and Terminal Alcohols from Alkenes. Journal of Organometallic Chemistry. 1977, s. 71–79. DOI 10.1016/S0022-328X(00)91817-5.
- 2013 CFR Title 29 Volume 6 Section 1900.1200 Appendix B.12
- Ilya V. Taydakov. Serious Explosion during Large-Scale Preparation of an Amine by Alane (AlH3) Reduction of a Nitrile Bearing a CF3 Group. ACS Chemical Health & Safety. 2020-07-08, s. 235–239. ISSN 1871-5532. DOI 10.1021/acs.chas.0c00045.

