Ethyl-akrylát
Ethyl-akrylát je organická sloučenina, ethylester kyseliny akrylové. Používá se na výrobu barev, textilií a netkaných vláken[2] a také jako reaktant při výrobě léčiv.
| Ethyl-akrylát | |
|---|---|
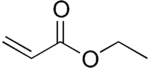
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | ethyl-propenoát |
| Ostatní názvy | ethylakrylát |
| Funkční vzorec | C2H3C(O)OCH2CH3 |
| Sumární vzorec | C5H8O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 140-88-5 |
| EC-no (EINECS/ELINCS/NLP) | 205-438-8 |
| PubChem | 8821 |
| SMILES | CCOC(=O)C=C |
| InChI | 1S/C5H8O2/c1-3-5(6)7-4-2/h3H,1,4H2,2H3 |
| Číslo RTECS | AT0700000 |
| Vlastnosti | |
| Molární hmotnost | 100,12 g/mol |
| Teplota tání | −71,2 °C (202,0 K)[1] |
| Teplota varu | 99,4 °C (372,6 K)[1] |
| Hustota | 0,923 g/cm3[1] |
| Index lomu | 1,4068 (20 °C)[1] |
| Rozpustnost ve vodě | 1,5 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru[1] |
| Tlak páry | 3,9 kPa (20 °C)[1] |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | −2743 kJ/mol[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H302 H312 H315 H317 H319 H332 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P270 P271 P272 P280 P301+312 P302+352 P303+361+353 P304+340 P305+351+338 P312 P321 P322 P330 P332+313 P333+313 P337+313 P362 P363 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | −3 °C (270 K)[1] |
| Teplota vznícení | 345 °C (618 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Ethyl-akrylát se vyrábí kysele katalyzovanou esterifikací kyseliny akrylové (získané oxidací propenu) ethanolem. Rovněž jej lze získat karbonylací z acetylenu, oxidu uhelnatého a ethanolu.[3]
Reakce a použití
Ethyl-akrylát slouží jako surovina na výrobu polymerních pryskyřic, plastů a kaučuků.[3]
Z ethyl-akrylátu se transesterifikací získávají za kyselé nebo zásadité katalýzy ostatní akrylátové estery, jako je 2-ethylhexyl-akrylát (získávaný z 2-ethylhexan-1-olu), součást lepidel odolných vůči vysokým tlakům, cyklohexylakrylát (z cyklohexanolu), používaný na výrobu automobilových laků, nebo 2-hydroxyethyl-akrylát (z ethylenglykolu), který může reagovat s diisokyanáty za vzniku gelů používaných s akryláty s dlouhým řetězcem (odvozených od alkoholů s 18 a více uhlíkovými atomy) jako komonomer při výrobě polymerů snižujících teplotu tuhnutí minerálních olejů. Dalším takovým esterem je 2-dimethylaminoethyl-akrylát, získávaný z dimethylethanolaminu, sloužící k výrobě vločkovacích látek a při výrobě papíru.
Jakožto reaktivní monomer bývá ethyl-akrylát složkou homopolymerů a kopolymerů například s ethenem, kyselinou akrylovou a jejími solemi, amidy a estery, methakryláty, akrylonitrilem, estery kyseliny maleinové, vinylacetátem, vinylchloridem, vinylidenchloridem, styrenem a butadienem.[4] Kopolymery ethyl-akrylátu s ethenem se používají jako lepidla a aditiva do polymerů, podobně jako kopolymery ethenu vinylacetátem.[5] Kopolymery s kyselinou akrylovou zlepšují čisticí schopnosti kapalných tenzidů, ty s kyselinou methakrylovou se využívají jako povlaky tablet léků na překyselení žaludku.[6]
Široké rozpětí možných komonomerů a jejich spojení do kopolymerů umožňuje vytvářet akrylátové kopolymery s mnoha různými způsoby využití například při výrobě barev, lepidel, papíru, textilních materiálů, kosmetiky a léků.
Protože se snadno polymerizuje, tak se do něj obvykle přidává inhibitor, jako je například hydrochinon.
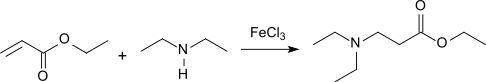
Ethyl-akrylát může reagovat s aminy za přítomnosti Lewisovy kyseliny (tato reakce se nazývá Michaelova reakce) za vzniku derivátů beta-alaninu:[7]
Jelikož patří ethyl-akrylát mezi α,β-nenasycené karbonylové sloučeniny, tak se často využívá, například při výrobě léčiv, možnost provedení nukleofilní adice. K takto vyráběným látkám patří mimo jiné hypnotikum glutethimid, vazodilatans vincamin[8] a nootropikum leteprinim.[9]
Ethyl-akrylát je dobrým dienofilem a reaguje tak s dieny v Dielsových–Alderových reakcích, například [4+2] cykloadiční reakcí s buta-1,3-dienem vzniká ester cyklohexenkarboxylové kyseliny.[10]
Ethyl-akrylát se také používá jako ochucovadlo. Nachází se ve stopových množstvích v ananasech a v sýru Beaufort[11] a rovněž byl nalezen v extraktu z vanilky. Ve vyšších koncentracích může negativně ovlivnit získané aroma.[12]
Reference
V tomto článku byl použit překlad textu z článku Ethyl acrylate na anglické Wikipedii.
- Ethyl acrylate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Takashi Ohara, Takahisa Sato, Noboru Shimizu, Günter Prescher Helmut Schwind, Otto Weiberg, Klaus Marten, Helmut Greim “Acrylic Acid and Derivatives” in Ullmann's Encyclopedia of Industrial Chemistry 2003, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a01_161.pub2
- Ethyl acrylate Archivováno 12. 10. 2006 na Wayback Machine Hazardous Substance Fact Sheet, New Jersey Department of Health and Senior Services
- Technical Data Sheet – Ethyl Acrylate [online]. dow.com [cit. 2013-02-20]. Dostupné v archivu pořízeném z originálu dne 2012-07-18.
- DuPontTM Elvaloy® AC Products and Properties [online]. dupont.com [cit. 2013-02-20]. Dostupné online.
- EUDRAGIT® L 100-55 - EUDRAGIT® - Targeted Drug Release and Tailored Service [online]. evonik.com [cit. 2013-02-20]. Dostupné online.
- Jose Cabral; Pierre Laszlo; Loïc Mahé; Marie-Thérèse Montaufier; S. Lalatiana Randriamahefa. Catalysis of the specific Michael addition: The example of acrylate acceptors. Tetrahedron Letters. 1989, s. 3969–3972. DOI 10.1016/S0040-4039(00)99297-9.
- Pharmazeutische Wirkstoffe: Synthesen, Patente, Anwendungen; von A. Kleemann u. J. Engel; 2., neubearb. u. erw. Aufl.; Stuttgart, New York; Thieme; 1982, ISBN 3-13-558402-X
- D. Lednicer, The Organic Chemistry of Drug Synthesis, Volume 7, J. Wiley & Sons, 2008, ISBN 978-0-470-10750-8
- K.P.C. Vollhardt, N.E. Schore, Organische Chemie, 5. Aufl., Wiley-VCH, 2012, ISBN 978-3-527-33250-2
- Ethyl Acrylate [online]. iarc.fr [cit. 2013-02-20]. Dostupné online.
- Sensory-Directed Flavor Analysis, Ray Marsili edit., CRC Press, Taylor & Francis Group, Boca Raton, 2007, ISBN 1-57444-568-5

