Vinylacetát
Vinylacetát (systematický název ethenyl-ethanoát) je organická sloučenina, která se používá na výrobu polyvinylacetátu.
| Vinylacetát | |
|---|---|
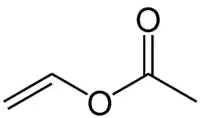
Strukturní vzorec | |
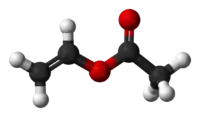
Model molekuly | |
| Obecné | |
| Systematický název | Ethenyl-ethanoát |
| Ostatní názvy | Ethenyl-acetát, ethenylester kyseliny ethanové, vinylester kyseliny octové |
| Anglický název | Vinyl acetate |
| Německý název | Vinylacetat |
| Funkční vzorec | H2C=CHO(CO)CH3 |
| Sumární vzorec | C4H6O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 108-05-4 |
| PubChem | 7904 |
| ChEBI | 46916 |
| SMILES | C=COC(C)=O |
| InChI | 1/C4H6O2/c1-3-6-4(2)5/h3H,1H2,2H3 |
| Vlastnosti | |
| Molární hmotnost | 86,089 g/mol |
| Teplota tání | −93,5 °C (159,6 K) |
| Teplota varu | 72,7 °C (345,8 K) |
| Hustota | 0,934 g/cm3 |
| Měrná magnetická susceptibilita | 5,39×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 |
| S-věty | S16 S23 S29 S33 |
| Teplota vzplanutí | −8 °C (265 K) |
| Teplota vznícení | 427 °C (700 K) |
| Meze výbušnosti | 2,6 až 13,4 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Hlavním způsobem průmyslové výroby vinylacetátu je reakce ethenu s kyselinou octovou a kyslíkem za přítomnosti palladia jako katalyzátoru:
- C2H4 + CH3CO2H + 1/2 O2 → CH3CO2CHCH2 + H2O
Dříve se vyráběl adicí plynné kyseliny octové na acetylen za přítomnosti kovového katalyzátoru. Tímto způsobem jej, s použitím rtuťnaté soli jako katalyzátoru, roku 1912 připravil Fritz Klatte.[2] Další možný postup spočívá v tepelném rozkladu ethylidendiacetátu:
- (CH3CO2)2CHCH3 → CH3CO2CHCH2 + CH3COOH
Polymerace
Vinylacetát může být polymerizován za vzniku polyvinylacetátu (PVA). Lze jej také v kombinaci s dalšími monomery použít na výrobu kopolymerů jako jsou ethylenvinylacetát (EVA), polyvinylchloridacetát (PVCA) a polyvinylpyrrolidon.[3]
Ostatní reakce
U vinylacetátu probíhá mnoho reakcí, které lze očekávat u alkenu nebo esteru. Adicí bromu vzniká 1,2-dibromvinylacetát. S halogenovodíky vinylacetát reaguje za vzniku 1-haloethylacetátů, které nelzte připravit jinými způsoby, protože neexistují odpovídající halogenalkoholy. S kyselinou octovou za přítomnosti palladiového katalyzátoru vytváří ethylidendiacetát (CH3CH(OAc)2). Transesterifikací lze z vinylacetátu získat mnoho karboxylových kyselin.[4] U této látky rovněž probíhají Dielsova–Alderova reakce a 2+2 cykloadice.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Vinylacetát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Vinylacetát na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Vinyl acetate na anglické Wikipedii.
- Vinyl acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- G. Roscher "Vinyl Esters" in Ullmann's Encyclopedia of Chemical Technology, 2007 John Wiley & Sons: New York
- VP/VA Copolymer [online]. Personal Care Products Council [cit. 2012-12-13]. Dostupné v archivu pořízeném dne 2012-10-16. (anglicky)
- D. Swern; E. F. JORDAN, JR. Vinyl Laurate and Other Vinyl Esters. Organic Syntheses, Collected Volume 4. 1963, s. 977. Dostupné online [cit. 2017-10-28]. (anglicky) Archivovaná kopie. www.orgsyn.org [online]. [cit. 2017-10-28]. Dostupné v archivu pořízeném z originálu dne 2011-06-05.


