Cyklopropen
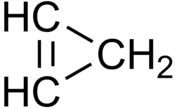
Cyklopropen je organická sloučenina se vzorcem C3H4, nejjednodušší cykloalken. Vzhledem k silnému úhlovému napětí je velmi reaktivní a obtížně se připravuje. Tato látka byla předmětem řady studií zabývajících se chemickými vazbami a reaktivitou.[1]
| Cyklopropen | |
|---|---|
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | cyklopropen |
| Sumární vzorec | C3H4 |
| Identifikace | |
| Registrační číslo CAS | 2781-85-3 |
| PubChem | 123173 |
| SMILES | C1C=C1 |
| InChI | 1S/C3H4/c1-2-3-1/h1-2H,3H2 |
| Vlastnosti | |
| Molární hmotnost | 40,064 g/mol |
| Teplota varu | −36 °C (237 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
V přírodě se samotný nevyskytuje, je však známo několik jeho derivátů přítomných v mastných kyselinách. Deriváty cyklopropenu se také používají na řízení zrání některých druhů ovoce.
Struktura
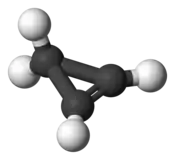
Molekula cyklopropenu má trojúhelníkovitý tvar. Kratší dvojné vazby alkenu oproti jednoduchým vazbám alkanu způsobují, že úhel vazby naproti dvojné vazbě se z 60° u cyklopropanu snižuje na 51°.[2]
Podobně jako u cyklopropanu má vazba uhlík–uhlík v kruhu posílenou povahu orbitalu p: alkenový uhlík vykazuje sp2,68 hybridizaci.[3]
Příprava cyklopropenu a jeho derivátů
První přípravy
První potvrzená příprava cyklopropenu spočívala v tepelném rozkladu hydroxidu trimethylcyklopropylamonného na hlíně pokryté platinou při 320–330 °C v CO2. Hlavními produkty reakce byly trimethylamin a dimethylcyklopropylamin, vytvořilo se však také kolem 5 % cyklopropenu. Cyklopropen byl také, s výtěžností 1 %, získán tepelným rozkladem aduktu cykloheptatrienu a dimethylacetylendikarboxylátu.
Syntézy z allylchloridů
Allylchlorid může být dehydrohalogenován amidem sodným při 80 °C, přičemž vzniká cyklopropen s výtěžností kolem 10 %.[4]
- CH2=CH-CH2Cl + NaNH2 → C3H4 + NaCl + NH3
Nejvýznamnějším vedlejším produktem je allylamin.
Z allylchloridu a bis(trimethylsilyl)amidu sodného ve vroucím toluenu se po 45–60 minutách vytvoří cyklopropen s výtěžností okolo 40 % a lepší čistotou:[5]
- CH2=CH-CH2Cl + NaN(TMS)2 → C3H4 + NaCl + NH(TMS)2
1-methylcyklopropen se připravuje podobným postupem, za pokojové teploty z methallylchloridu a za přítomnosti fenyllithia jako zásady:[6]
- CH2=C(CH3)CH2Cl + LiC6H5 → CH3C3H3 + LiCl + C6H6
Příprava derivátů
Působením methoxidu sodného na nitrocyklopropany dochází k odštěpení dusitanu za tvorby příslušného derivátu cyklopropenu. Příprava čistě alifatických cyklopropenů byla poprvé dosažena pomocí adice karbenů na alkyny za katalýzy mědí. Ethyldiazoacetát za přítomnosti mědi reaguje s acetyleny a tvoří se cyklopropeny. 1,2-dimethylcyklopropen-3-karboxylát lze obdobným způsobem vytvořit z but-2-ynu. Nejčastějšími katalyzátory používanými při těchto reakcích jsou prášková měď a síran měďnatý; lze také použít octan rhodnatý.
Adicí dichlorkarbenu na tetrachlorethen vzniká tetrachlorcyklopropen.
Reakce
Studie reaktivity cyklopropenu byly zaměřené především na působení jeho úhlového napětí. Při 425 °C se cyklopropen izomerizuje na propyn.
- C3H4 → H3CC≡CH
Při pokusech o frakční destilaci cyklopropenu při –36 °C, tedy jeho teplotě varu, docházelo k polymerizaci; její mechanismus je pravděpodobně radikálový, produktem by, podle NMR spekter, měl být polycyklopropan.
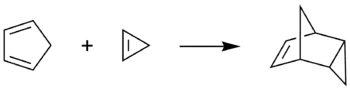
Cyklopropen vstupuje do Dielsových–Alderových reakcí, například s cyklopentadienem se tvoří endo-tricyklo[3.2.1.02,4]okt-6-en. Tato reakce se často používá k ověření přítomnosti cyklopropenu po jeho syntéze.[5]
Podobné sloučeniny
- Kyselina malvalová je toxická mastná kyselina založená na cyklopropenu, vyskytující se v oleji z bavlníkových semen.
- 1-Methylcyklopropen (1-MCP) se používá na omezení zrání ovoce.[7][8]
- Borireny, fosfireny a silireny jsou cyklopropeny substituované borem, fosforem a křemíkem, se vzorci RBC2R'2, RPC2R'2 a R2SiC2R'2.
Reference
V tomto článku byl použit překlad textu z článku Cyclopropene na anglické Wikipedii.
- F. L. Carter; V. L. Frampton. Review of the Chemistry of Cyclopropene Compounds. Chemical Reviews. 1964, s. 497–525. DOI 10.1021/cr60231a001.
- S. W. Staley; T. D. Norden; C.-F. Su; M. Rall; M. D. Harmony. Structure of 3-cyanocyclopropene by microwave spectroscopy and ab initio molecular orbital calculations. Evidence for substituent-ring double bond interactions. Journal of the American Chemical Society. 1987, s. 2880–2884. DOI 10.1021/ja00244a004.
- F. H. Allen. The geometry of small rings: Molecular geometry of cyclopropene and its derivatives. Tetrahedron. 1982, s. 645–655. DOI 10.1016/0040-4020(82)80206-8.
- G. L. Closs; K. D. Krantz. A Simple Synthesis of Cyclopropene. Journal of Organic Chemistry. 1966, s. 638. DOI 10.1021/jo01340a534.
- BINGER, P.; WEDERMANN, P.; BRINKER, U. H. Cyclopropene: A New Simple Synthesis and Its Diels-Alder reaction with Cyclopentadiene. Org. Synth.. 2000, s. 254. Dostupné online. (anglicky); Coll. Vol.. S. 231. (anglicky)
- T. C. Clarke; C. D. Duncan; R. M. Magid. An Efficient and Convenient Synthesis of 1-Methylcyclopropene. Journal of Organic Chemistry. 1971, s. 1320–1321. DOI 10.1021/jo00808a041.
- R. Beaudry; C. Watkins. Use of 1-MCP on Apples. Perishable Handling Quarterly. 2001, s. 12.
- G. D. Trinchero; G. O. Sozzi; F. Covatta; A. A. Fraschina. Inhibition of ethylene action by 1-methylcyclopropene extends postharvest life of "Bartlett" pears. Postharvest Biology and Technology. 2004, s. 193–204. DOI 10.1016/j.postharvbio.2003.11.009.