Neutralizace
Neutralizace je chemická reakce stejného množství kyseliny a zásady. Produkty této reakce jsou příslušná sůl kyseliny a voda. Klasickým příkladem je reakce kyseliny chlorovodíkové a hydroxidu sodného, při níž vzniká chlorid sodný:
HCl + NaOH → NaCl + H2O
Neutralizační reakce zpravidla probíhají ve vodných roztocích. Kyselé roztoky lze neutralizovat zásaditými roztoky a naopak. Silné kyseliny vytvářejí oxoniové ionty H3O+ zcela rozpuštěné ve vodě s pH < 7, silné báze vytvářejí zcela rozpuštěné hydroxidové ionty OH− s pH > 7. V průběhu této reakce dochází ke změnám pH roztoku a dokonale neutralizovaný roztok má výsledné pH = 7.
Neutralizační reakce se využívají v chemických laboratořích, při zpracování surovin, při výrobě mnoha látek nebo při úpravě odpadních vod.
Neutralizační bod
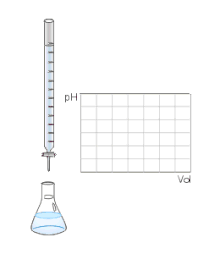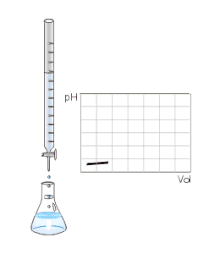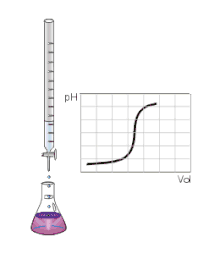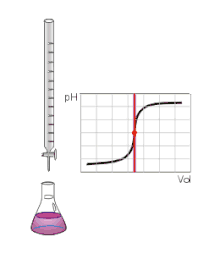
Kyselina a zásada jsou zcela neutralizovány, když je dosaženo neutralizačního bodu. V tomto bodě má roztok hodnotu pH = 7 a to odpovídá hodnotě pH čisté vody. Takový roztok se nazývá neutrální.
Dosažení neutrality roztoku závisí na síle kyseliny a zásady. Pokud spolu reagují zcela disociovaná silná kyselina a silná zásada, pak se neutralizačního bodu dosáhne při jejich stejné koncentraci.
Pokud spolu reaguje slabá kyselina (s nízkou disociační konstantou) se silnou zásadou (s vysokou disociační konstantou) nebo slabá báze se silnou kyselinou, pak je neutralizačního bodu dosaženo při jiných koncentracích obou složek. Je zřejmé, že pro neutralizaci silné kyseliny bude třeba více slabé zásady a stejně to platí i obráceně.
Neutralizace a teplo
Neutralizace je exotermická reakce, neboť při reakci
H+ + OH− → H2O
se uvolňuje 57,30 kJ/mol.
Intenzita reakce a uvolněné teplo se zvyšuje s koncentrací kyseliny a zásady. Zatímco při koncentraci kyseliny a zásady 1 mol/l nejsou viditelné žádné reakce, při vysokých koncentracích reakčních látek (například 98% kyseliny sírové) je reakce extrémně rychlá až explozivní.
Silné kyseliny a silné zásady
Silná kyselina je plně disociována ve vodném roztoku. Například kyselina chlorovodíková HCl je silná kyselina a disociuje podle rovnice:
HCl(aq) → H+(aq) + Cl−(aq)
Silná zásada je plně disociována ve vodném roztoku. Například hydroxid sodný NaOH je silná zásada a disociuje podle rovnice:
NaOH(aq) → Na+(aq) + OH−(aq)
Neutralizační reakce pak může být zapsána:
H+ + OH− → H2O
Iont H+ ve vodě samostatně neexistuje, váže se na molekulu vody za vzniku oxoniového iontu H3O+. Proto rovnice přesněji zní takto:
H3O+ + OH− → H2O + H2O → 2 H2O
Pro dosažení neutralizačního bodu je třeba, aby spolu zreagovalo stejné množství kyseliny a zásady. V roztoku pak nezůstanou žádné přebytečné vodíkové ani hydroxidové ionty. Roztok je neutrální a má pH = 7.
Slabé kyseliny a slabé zásady
Pro slabé kyseliny a slabé báze platí, že nejsou zcela disociovány a často vůbec nedojde k jejich neutralizaci. Při obou dalších kombinacích, tedy silná kyselina a slabá zásada nebo slabá kyselina a silná zásada, záleží na jejich disociační konstantě - disociační konstanta kyseliny KA nebo disociační konstanta zásady KB.
Využití neutralizace
Neutralizační reakce mají široké využití v chemických laboratořích a také v praxi. Metody chemické titrace se používají pro analýzu kyselin nebo bází, ke stanovení jejich neznámé koncentrace nebo jejich odstranění.
Čištění odpadních vod
Při čištění odpadních vod se často používají chemické neutralizační metody, aby se snížily škody při uvolňování kyselých nebo zásaditých látek do životního prostředí. Mezi používané chemické látky k neutralizaci odpadních vod patří uhličitan vápenatý, oxid vápenatý, hydroxid hořečnatý nebo hydrogenuhličitan sodný. Výběr vhodné neutralizační chemické látky závisí na konkrétním znečištění odpadní vody a použité aplikaci.
Hnojiva
Dalším běžným použitím neutralizačních reakcí je výroba a použití hnojiv. Některé rostliny vyžadují kyselejší a jiné zásaditější půdu. Proto jsou hnojiva selektivně vyráběna pro určité plodiny. Známý je vápenec (CaCO3), který se dodává do příliš kyselých půd. Hnojiva, která zlepšují růst rostlin, se vyrábějí neutralizací kyseliny sírové (H2SO4) nebo kyseliny dusičné (HNO3) amoniakem (NH3) za vzniku síranu amonného nebo dusičnanu amonného. Tyto soli jsou pak vpravovány do půdy jako dusíkatá hnojiva.
Čistota ovzduší
Při spalování uhlí uniká do vzduchu mimo jiné oxid siřičitý, který reaguje s vodní párou ve vzduchu za vzniku kyseliny sírové. Ta potom padá na zem jako kyselý déšť. Aby se zabránilo úniku oxidu siřičitého do vzduchu, využívá se neutralizačních reakcí. V čisticím zařízení se nejprve do spalovací komory vhání uhličitan vápenatý, ten se rozkládá na oxid vápenatý a oxid uhličitý. Oxid vápenatý pak reaguje s oxidem siřičitým za vzniku siřičitanu vápenatého. Ten se následně vysráží a odstraní.
Medicína
Existuje mnoho neutralizačních reakcí, které probíhají v organismech a při chorobách způsobují potíže nebo onemocnění. K velmi častým potížím patří překyselení žaludku způsobené přebytkem žaludeční kyseliny (kyselina chlorovodíková - HCl), která může způsobovat poleptání jeho stěn a následně žaludeční vředy. Její neutralizace lze dosáhnout jedlou sodou - hydrogenuhličitanem sodném (NaHCO3).
Dále v trávicím traktu ve střevech je naopak potřeba alkalické prostředí, aby byly živiny dobře absorbovány střevní stěnou. To zajišťuje, mimo jiné své funkce, slinivka břišní, která produkuje alkalické látky.
Reference
V tomto článku byly použity překlady textů z článků Neutralization (Chemistry) na anglické Wikipedii a Neutralisation (Chemie) na německé Wikipedii.