Žíravina
Žíravina (též žíravá látka) je chemická látka, která může zničit nebo nevratně poškodit jinou látku, se kterou přijde do styku. Žíraviny jsou nebezpečné zejména pro možnost poškození očí, kůže nebo tkáně pod kůží, vdechování nebo požití žíraviny může poškodit dýchací, resp. trávicí ústrojí. Expozice žíravině vede k poleptání.

Žíraviny se v rámci Globálně harmonizovaného systému klasifikace a označování chemikálií (GHS) označují následujícím piktogramem:
Termín
Pod vlivem angličtiny se někdy objevuje označení korozivní látka (původem z corrosive substance). Termín korozivní se však v češtině tradičně vztahuje k poškození (korozi) materiálů, zejména kovů, proto takové označení není přesné. Dříve se pojem žíravina vztahoval pouze na látky zásadité (alkalické), nikoli na kyseliny, silné oxidanty atd.
Žíraviny v nízké koncentraci jsou obvykle dráždivé. Označení látky symbolem „žíravý“ (GHS05) v Globálně harmonizovaném systému může být založeno jak na žíravosti pro živé tkáně, tak vzhledem k neživým materiálům (kovům).
Žíraviny se liší od jiných škodlivin tím, že jsou bezprostředně nebezpečné při styku s tkání, kdežto jedy mají systémový toxický účinek, který potřebuje určitý čas k tomu, aby se projevil. Kolokviálně lze žíraviny označovat jako „jedy“, ale technicky jde o odlišnou věc. Žíravina ovšem může být současně i jedem, tedy existují látky, které jsou jak žíravé, tak jedovaté (např. fenol).
Žíravost

Typickými žíravinami jsou silné kyseliny (kyselina sírová, dusičná atd.) a zásady (hydroxid sodný, draselný atd.), nebo koncentrované roztoky některých slabých kyselin (kyselina mravenčí, octová, glykolová) a zásad. Jejich účinek na živou tkáň je založen na acidobazické katalýze hydrolýzy esterů a amidů. Žíravé kyseliny a zásady jsou schopny odtučňovat kůži katalýzou hydrolýzy tuků, které chemicky patří mezi estery. Bílkoviny jsou chemicky amidy, které mohou být také hydrolyzovány touto cestou. Silné kyseliny a zásady denaturují bílkoviny a také snadno hydratují. Hydratace odstraňuje vodu ze tkáně a je významně exotermická. Například koncentrovaná kyselina sírová působí kromě poleptání také popáleniny. Silná oxidační činidla, například koncentrovaný peroxid vodíku, mohou být také žíravá pro tkáně nebo jiné materiály, i když je jejich hodnota pH téměř neutrální. Příkladem silné kyseliny, které je současně silným oxidantem, je kyselina dusičná. Je výrazně žíravější, než by se dalo očekávat podle hodnoty pKa.
Existují také specifičtější žíraviny. Například kyselina fluorovodíková působí v nižších koncentracích bezbolestně, ale snadno proniká tkání a selektivně napadá kosti, což činí práci s ní extrémně nebezpečnou. Technicky je to slabá kyselina, ale tvoří fluoridový iont (původce žíravosti) poté, co je bezbolestně vstřebána. Roztoky chloridu zinečnatého jsou normálně kyselé (podle Brønstedovy definice), avšak zinkový kation také specificky napadá hydroxylové skupiny jako Lewisova kyselina. To vysvětluje schopnost chloridu zinečnatého reagovat s celulózou a poškozovat papír a hedvábí.
Běžné typy žíravin
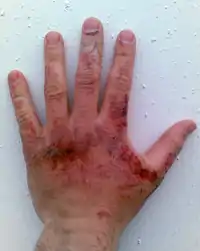
Běžné žíravé chemikálie lze rozdělit na:
- kyseliny
- silné kyseliny – nejobvyklejší jsou kyselina sírová (H2SO4), kyselina dusičná (HNO3) a kyselina chlorovodíková (HCl)
- některé koncentrované slabé kyseliny, například kyselina octová
- roztoky Lewisových kyselin se specifickou reaktivitou, např. roztoky chloridu zinečnatého
- zásady
- hydroxidy (louhy), například hydroxid sodný (NaOH) nebo hydroxid draselný (KOH)
- alkalické kovy v kovové formě (např. elementární sodík) a jako hydridy, dále hydráty kovů zásaditých zemin (např. hydroxid vápenatý)
- některé koncentrované slabé zásady, například bezvodý amoniak nebo jeho koncentrované roztoky
- dehydratující činidla, například oxid fosforečný, oxid vápenatý, bezvodý chlorid zinečnatý, také elementární alkalické kovy
- silné oxidanty, například koncentrovaný peroxid vodíku
- elektrofilní halogeny: elementární fluor, chlor, brom a jód, elektrofilní soli jako chlornan sodný nebo N-chlorové sloučeniny jako chloramin-T[1]; halogenidové ionty nejsou žíravé
- organické halogenidy a organické kyseliny halogenidů, například acetylchlorid a benzylchloroformát
- anhydridy kyselin
- alkylační činidla, například dimethylsulfát
- některé organické látky, například fenol (kyselina karbolová)
Související články
Reference
V tomto článku byl použit překlad textu z článku Corrosive substance na anglické Wikipedii.
- International Chemical Safety Card for Chloramine-T. www.cdc.gov [online]. [cit. 2008-12-12]. Dostupné v archivu pořízeném dne 2008-10-10.
Externí odkazy
 Obrázky, zvuky či videa k tématu Žíravina na Wikimedia Commons
Obrázky, zvuky či videa k tématu Žíravina na Wikimedia Commons  Slovníkové heslo žíravina ve Wikislovníku
Slovníkové heslo žíravina ve Wikislovníku
