Chlorečnan sodný
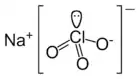
Chlorečnan sodný je anorganická sloučenina s chemickým vzorcem (NaClO3). V čisté podobně jde o bílý krystalický prášek snadno rozpustný ve vodě. Je hygroskopický. Při teplotě 250 °C se rozkládá na kyslík a chlorid sodný.
| Chlorečnan sodný | |
|---|---|

Prášková forma | |
Vzorec | |
 | |
| Obecné | |
| Systematický název | Chlorečnan sodný |
| Ostatní názvy | Travex |
| Anglický název | Sodium chlorate |
| Německý název | Natriumchlorat |
| Sumární vzorec | NaClO3 |
| Vzhled | bílé krystalky nebo prášek |
| Identifikace | |
| Registrační číslo CAS | 7775-09-9 |
| EC-no (EINECS/ELINCS/NLP) | 231-887-4 |
| Indexové číslo | 017-005-00-9 |
| Vlastnosti | |
| Molární hmotnost | 106,441 g/mol |
| Teplota tání | 255 ± 6 °C |
| Teplota varu | rozklad |
| Hustota | 2,49 g/cm3 (15 °C) 2,487 g/cm3 (25 °C) |
| Rozpustnost ve vodě | 79,89 g/100 g (0 °C) 95,57 g/100 g (20 °C) 125,59 g/100 g (50 °C) 137,72 g/100 g (60 °C) 165,96 g/100 g (80 °C) 200,69 g/100 g (100 °C) |
| Relativní permitivita εr | 5,76 (28 °C) |
| Měrná magnetická susceptibilita | −3,97·10−6 cm3g−1 |
| Povrchové napětí | 88,9 mN/m (290 °C) |
| Struktura | |
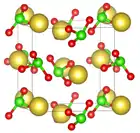
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=657 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −372,3 kJ/mol |
| Entalpie tání ΔHt | 212 J/g |
| Standardní molární entropie S° | 129,7 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −274,4 kJ/mol |
| Izobarické měrné teplo cp | 0,983 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H271 H302 H411 |
| R-věty | R9, R22, R51/53 |
| S-věty | S2, S13, S17, S46, S61 |
| NFPA 704 |  0
1
2
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Syntéza
Chlorečnan sodný se průmyslově vyrábí elektrolýzou horkého chloridu sodného. Vyrábí se v elektrolyzérech bez diafragmy (polopropustné přepážky) za zvýšené teploty (do 70 °C). Používá se katoda z nízkouhlíkaté oceli a anoda z aktivovaného titanu. Na katodě vzniká vodík:
- 2 H2O + 2e → H2 + 2 OH−
Na anodě vzniká chlor, který s vodou reaguje na kyselinu chlornou a současně reaguje s hydroxylovými ionty vzniklými na katodě:
- Cl2 + H2O → HClO + HCl
- Cl2 + OH− → ClO− + HCl
Vzniklý chlornanový aniont reaguje při vyšších teplotách s kyselinou chlornou za vzniku chlorečnanu:
- 2 HClO + ClO− → ClO3− + 2 HCl
Probíhá i nežádoucí redukce chlornanového na chloridový aniont, která se téměř zcela potlačí přídavkem cca 3 g chlornanu na 1 l elektrolytu.
Z výsledného roztoku se chlorečnan získává v krystalické formě odpařením, přičemž nejprve krystalizuje chlorid sodný.
Chlorečnan sodný lze syntetizovat také průchodem plynného chloru horkým roztokem hydroxidu sodného. Poté se čistí krystalizací.
Použití
Herbicidy
Chlorečnan sodný se používá jako neselektivní herbicid. Je považován za fytotoxický pro všechny části zelených rostlin. Může je ničit také absorpcí přes kořeny.
Chlorečnan sodný lze použít proti těmto rostlinám:
- svlačcovití
- pcháč rolní
- čirok halepský
- bambus
- starček
- třezalka tečkovaná
Herbicid se používá hlavně na nesečenou plochu pro ohniskovou aplikaci a pro úplné odstraňování vegetace na krajnicích silnic, oploceních, příkopech a podobně.
Chlorečnan sodný se používá také jako defoliant a desikant pro tyto rostliny:
- bavlna,
- světlice barvířská,
- kukuřice,
- len,
- pepř,
- sója,
- čirok,
- vigna čínská,
- fazol obecný,
- rýže
- slunečnice
V kombinaci s atrazinem se zvyšuje perzistence účinku. Použití v kombinaci s 2,4-D účinek posiluje. Chlorečnan sodný způsobuje neplodnost půdy. Míšení s jinými herbicidy ve vodných roztocích je do určité míry možné, pokud nejsou tyto herbicidy náchylné na oxidaci.
Chemické uvolňování kyslíku
Chemický generátor kyslíku se používá například v dopravních letadlech – poskytuje kyslík v nouzových situacích (pokles tlaku v prostoru pro cestující). Funguje na bázi katalytického rozkladu chlorečnanu sodného. Jako katalyzátor se obvykle používá železný prášek. Při rozkladu vzniká také menší množství chloru, to se odstraňuje oxidem barnatým.[2]
Chlorečnan sodný se v některých letadlech používá jako zdroj doplňkového kyslíku. Železný prášek se smísí s chlorečnanem sodným a zažehne se výbojem, který se aktivuje vytažením kyslíkové masky. Reakce produkuje více kyslíku, než je potřeba na spalování.
Potlačování bakterií u jatečních zvířat
Podle zjištění Agricultural Research Service může podávání malých dávek chlorečnanu sodného prasatům a skotu významně snížit množství bakterií Salmonella typhimurium a Escherichia coli v jejich zažívacím traktu. Uvedené bakterie mají enzym respiratorní nitrátreduktázu, který mění chlorečnan na baktericidní chloritan. Uvažuje se o podávání před transportem zvířat na jatka nebo do napájecí vody na jatkách.[3]
Toxicita pro člověka
Vzhledem ke své oxidační povaze je chlorečnan sodný velmi škodlivý při požití. Oxidační účinek na hemoglobin vede ke tvorbě methemoglobinu následované denaturací globinové bílkoviny a prokřížení membránových bílkovin v červených krvinkách, což vede k poškození membránových enzymů. Permeabilita membrány se sníží a dochází k vážné hemolýze. Denaturace hemoglobinu překračuje kapacitu metabolické dráhy G6PD. Navíc je tento enzym přímo denaturován chlorečnanem a omezuje se tak jeho účinek.
Účinná může být léčba kyselinou askorbovou a methylenovou modří. Ovšem protože methylenová modř vyžaduje přítomnost NADPH, pro kterou je potřeba normální funkce systému G6PD, je méně účinná než za jiných podmínek oxidace hemoglobinu. Může nastat vážná akutní hemolýza s multiorgánovým selháním, včetně diseminované intravaskulární koagulace a selhání ledvin.
Přípravky
Chlorečnan sodný se dodává jako prášek, sprej nebo granule. Smíšení suchého chlorečnanu s jinými látkami, zejména organickými materiály (včetně ostatních herbicidů), sírou, fosforem, práškovými kovy a silnými kyselinami, je nebezpečné a může vést k požáru či výbuchu. Zejména při smíšení s cukrem vzniká nebezpečná výbušnina. Dojde-li k náhodnému smíšení chlorečnanu s některou z takových látek, neponechávejte směs doma, v garáži apod.[4]
Komerční výrobky obsahují zpomalovač hoření, ale ten má jen malý účinek při silném vznícení. Většina komerčních přípravků proti plevelu obsahuje přibližně 53 % chlorečnanu sodného. Zbývající část je zpomalovač hoření, například dioxoboritan sodný nebo fosforečnan amonný.
Obchodní značky
Chlorečnan sodný jako aktivní složka je obsažen v řadě komerčních herbicidů. Mezi ně patří například Atlacide, Defol, De-Fol-Ate, Drop-Leaf, Fall, Harvest-Aid, Kusatol, Leafex, nebo Tumbleaf. Sloučeninu lze použít v kombinaci s dalšími herbicidy, např. atrazinem, 2,4-D, bromacilem, diuronem nebo dioxoboritanem sodným. Ve Velké Británii existuje mnoho značek přípravku proti plevelu s chlorečnanem sodným – například Doff nebo Wilkinsons. V Itálii je obsažen v přípravcích značky Zapi prodávaných jako "Grasskiller Liquid". V České republice se dříve prodával přípravek Travex.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Reference
V tomto článku byl použit překlad textu z článku Sodium chlorate na anglické Wikipedii.
- Sodium chlorate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Yunchang Zhang, Girish Kshirsagar, and James C. Cannon. Functions of Barium Peroxide in Sodium Chlorate Chemical Oxygen. Ind. Eng. Chem. Res.. 1993, roč. 32, čís. 5, s. 966–969. DOI 10.1021/ie00017a028.
- Chlorečnan sodný proti salmonelám – Argonavigátor[nedostupný zdroj]
- BEVERIDGE, Alexander. Forensic Investigation of Explosions. [s.l.]: Taylor & Francis Ltd, 1998. ISBN 0-7484-0565-8.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorečnan sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorečnan sodný na Wikimedia Commons


