Oxid barnatý
Oxid barnatý (BaO) je oxidem barya, kde je baryum v oxidačním stavu II. Je to anhydrid hydroxidu barnatého.
| Oxid barnatý | |
|---|---|
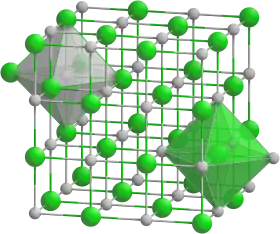
Krystalová mřížka kubické modifikace oxidu barnatého | |
| Obecné | |
| Systematický název | Oxid barnatý |
| Anglický název | Barium oxide |
| Německý název | Bariumoxid |
| Sumární vzorec | BaO |
| Vzhled | bílá až žlutá práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 1304-28-5 |
| Číslo RTECS | CQ9800000 |
| Vlastnosti | |
| Molární hmotnost | 153,33 g/mol |
| Teplota tání | 1 923 °C |
| Teplota varu | 2 000 °C |
| Hustota | 5,72 g/cm3, (15 °C, α) 5,32 g/cm3, (20 °C, β) |
| Index lomu | nD= 1,980 (15 °C) |
| Rozpustnost ve vodě | 3,48 g/100 ml (0 °C) 90,8 g/100 ml (100 °C) |
| Relativní permitivita εr | 14,3 |
| Struktura | |
| Krystalová struktura | krychlová plošně centrovaná (α) šesterečná (β) |
| Hrana krystalové mřížky | α-modifikace a= 552,3 pm |
| Dipólový moment | 7,95×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −558,1 kJ/mol (β) −565,2 kJ/mol (α) |
| Entalpie tání ΔHt | 376,8 J/g |
| Entalpie varu ΔHv | 1 692 J/g |
| Standardní molární entropie S° | 70,3 JK−1mol−1 (β) |
| Standardní slučovací Gibbsova energie ΔGf° | −528,4 kJ/mol (β) −528,8 kJ/mol (α) |
| Izobarické měrné teplo cp | 0,309 JK−1g−1 (β) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R20/22 |
| S-věty | (S2), S28 |
| NFPA 704 |  0
3
2
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Použití
Oxid barnatý se používá jako chemický generátor kyslíku (používá se například v dopravních letadlech – poskytuje kyslík v nouzových situacích (pokles tlaku v prostoru pro cestující)). Funguje na bázi katalytického rozkladu chlorečnanu sodného. Jako katalyzátor se obvykle používá železný prášek. Při rozkladu vzniká také menší množství chloru, to se odstraňuje oxidem barnatým[2].
Používá se také jako přísada při výrobě skla pro speciální účely, např. při výrobě flintového nebo křišťálového skla.
Reference
- Barium oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Yunchang Zhang, Girish Kshirsagar, and James C. Cannon. Functions of Barium Peroxide in Sodium Chlorate Chemical Oxygen. Ind. Eng. Chem. Res.. 1993, roč. 32, čís. 5, s. 966–969. DOI 10.1021/ie00017a028.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



