Řízená ortho-metalace
Řízená ortho-metalace je organická reakce, druh elektrofilní aromatické substituce, kde se elektrofil navazuje pouze do polohy ortho řídicí skupiny metalační reakce za pomoci aryllithné sloučeniny.[1]
Řídicí skupina s lithiem interaguje prostřednictvím heteroatomu. Jako řídicí skupiny se u orthometalací často objevují methoxyskupiny, terciární aminy a amidy.
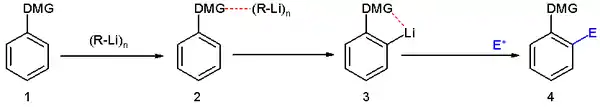
Na obrázku výše je znázorněná obecná ortho-metalační reakce. Aromatický kruh s řídicí skupinou 1 interaguje s alkyllithnou sloučeninou, například n-butyllithiem na meziprodukt 2, přičemž heteroatom na řídicí skupině je Lewisovou zásadou a lithium Lewisovou kyselinou. Silně zásadité alkyllithium poté deprotonuje kruh na nejbližší ortho-pozici a vytvoří aryllithnou sloučeninu 3 za zachování interakcí mezi kyselinou a zásadou. V dalším kroku se elektrofil zúčastní elektrofilní aromatické substituce s výraznou převahou substituce do polohy ipso vůči lithiu.
Běžné elektrofilní substituce s aktivujícími substituenty upřednostňují pozice ortho i para, takže cílením na ortho se zvyšuje regioselektivita reakce.
Tento druh reakce nezávisle na sobě popsali Henry Gilman a Georg Wittig kolem roku 1940.[2][3]
Příklady
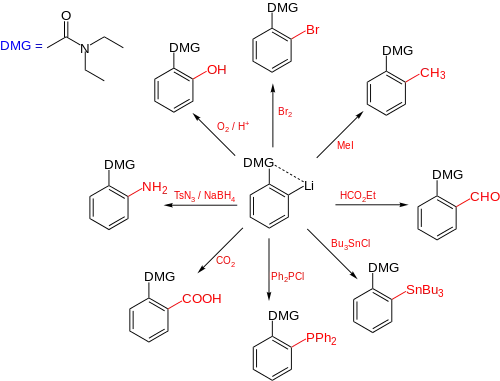
Řízené orthometalace se obvykle provádějí u terciárních aminů a benzylaminů.[4][5]
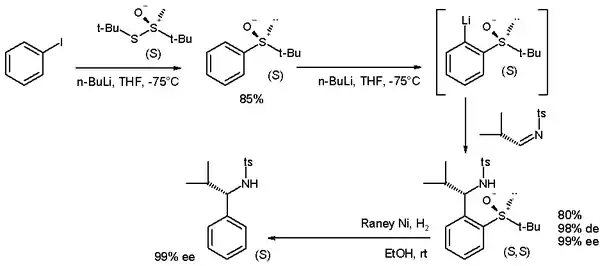
Také byly použity na přípravu enantiomerně čistých benzylaminů[6] ortho-lithiací terc-butylfenylsulfoxidu. K získání lithného meziproduktu vedla asymetrická indukce vyvolaná tosylovou skupinou na iminovém elektrofilu.
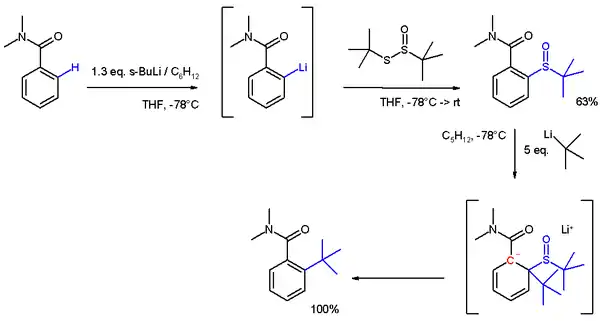
Další využití řízené orthometalace spočívalo v navázání terc-butylové skupiny do polohy ortho.[7] Lithiace je nukleofilní aromatickou substitucí a následná reakce za vzniku sulfoxidu elektrofilní aromatickou substitucí. V posledním kroku se použije terc-butyllithium jako nukleofil pro další nukleofiní aromatickou substituci přes aniontový meziprodukt.
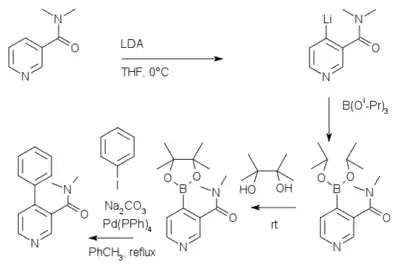
Řízená ortho-metalace byla také spojena se Suzukiovou reakcí:[8] Výchozím materiálem je zde nikotinamid, jenž je lithiován a vzniklý meziprodukt reaguje s triisopropoxyboranem na boronátový ester, jenž reaguje s pinakolem a nakonec s jodbenzenem za přítomnosti tetrakis(trifenylfosfin)palladia.
U thiofenolů
Řízenou ortho-metalací lze také přeměnit thiofenoly na sloučeniny použitelné jako ligandy.[9]
Podobné reakce
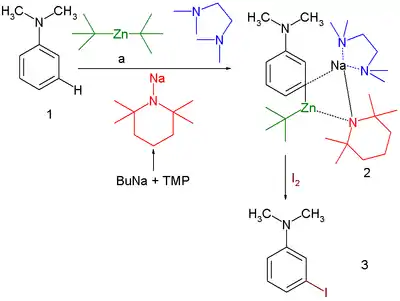
Řízné metalace nejsou omezeny na lithné meziprodukty ani na ortho-substituce, například reakcí N,N-dimethylanilinu s komplexem tetramethylethylendiaminu, sodné soli 2,2,6,6-tetramethylpiperidinu a di-terc-butylzinku vzniká stálý meta-zinkovaný komplex,[10] který může reagovat s jodem za vzniku N,N-dimethyl-3-jodanilinu. Reakce probíhá v hexan za pokojové teploty. Délky vazeb jsou: Zn-C = 203,5 pm ve stejné rovině jako aryl, Na-C = 269 pm 76° od roviny arylu.
Reference
V tomto článku byl použit překlad textu z článku Directed ortho metalation na anglické Wikipedii.
- Victor Snieckus. Directed ortho metalation. Tertiary amide and O-carbamate directors in synthetic strategies for polysubstituted aromatics. Chemical Reviews. 1990, s. 879–933. DOI 10.1021/cr00104a001.
- Relative Reactivities of Organometallic Compounds. XX.* Metalation Henry Gilman, Robert L. Bebb Journal of the American Chemical Society; 1939; 61(1); 109-112. DOI:10.1021/ja01870a037
- Georg Wittig et al. Chemische Berichte 1940, 73, 1197
- Gamal A. El-Hiti; Keith Smith; Amany S. Hegazy; Mohammed B. Alshammari; Ali Masmali. Directed lithiation of simple aromatics and heterocycles for synthesis of substituted derivatives. Arkivoc. 2015, s. 19–48. Dostupné online. DOI 10.3998/ark.5550190.p008.744.
- J. V. Hay And T. M. Harris "Dimethylamino-5-methylphenyl)diphenylcarbinol" Organic Syntheses 1973, volume 53, 56. DOI:10.15227/orgsyn.053.0056
- ortho-Metalation of Enantiopure Aromatic Sulfoxides and Stereocontrolled Addition to Imines Nicolas Le Fur, Ljubica Mojovic, Nelly Plé, Alain Turck, Vincent Reboul, and Patrick Metzner The Journal of Organic Chemistry; 2006; 71(7) pp 2609 - 2616; Abstract
- Contra-Friedel–Crafts tert-butylation of substituted aromatic rings via directed metallation and sulfinylation Jonathan Clayden, Christopher C. Stimson and Martine Keenan Chemical Communications, 2006, 1393 - 1394 Abstract
- Directed ortho Metalation-Boronation and Suzuki-Miyaura Cross Coupling of Pyridine Derivatives: A One-Pot Protocol to Substituted Azabiaryls Manlio Alessi, Andrew L. Larkin, Kevin A. Ogilvie, Laine A. Green, Sunny Lai, Simon Lopez, and Victor Snieckus The Journal of Organic Chemistry; 2007; 72(5) pp 1588 - 1594. DOI:10.1021/jo0620359
- Directed ortho-lithiation of lithium thiophenolate. New methodology for the preparation of ortho-substituted thiophenols and related compounds Garret D. Figuly, Cynthia K. Loop, J. C. Martin J. Am. Chem. Soc.; 1989; 111 pp 654-658 DOI:10.1021/ja00184a038. Ortho-Lithiothiophenol Equivalents: Generation, Reactions and Applications in Synthesis of Hindered Thiolate Ligands Eric Block, Venkatachalam Eswarakrishnan, Michael Gernon, Gabriel Ofori-Okai, Chantu Saha, Kaluo Tang, Jon Zubieta Journal of the American Chemical Society; 1989; 111 pp 658-665. DOI:10.1021/ja00184a039 Directed lithiation of arenethiols Keith Smith, Charles M. Lindsay, Gareth J. Pritchard Journal of the American Chemical Society; 1989; 111 pp 665-669; DOI:10.1021/ja00184a040. 2-Phosphino- and 2-Phosphinyl-benzenethiols: New Ligand Types Eric Block, Gabriel Ofori-Okai and Jon Zubieta Journal of the American Chemical Society; 1989; 111 pp 2327-2329; DOI:10.1021/ja00188a071. Co-complexes of ortho-dilithiated thiophenol or 2-trimethylsilylthiophenol with lithiated TMEDA molecules: synthesis, crystal structures and theoretical studies (TMEDA = N,N,N′,N′-tetramethylethylenediamine) Alexandra Hildebrand, Peter Lönnecke, Luminita Silaghi-Dumitrescu, Ioan Silaghi-Dumitrescu and Evamarie Hey-Hawkins Dalton Transactions; 2006; 967-974; DOI:10.1039/B511827A
- Directed meta-Metalation Using Alkali-Metal-Mediated Zincation David R. Armstrong, William Clegg, Sophie H. Dale, Eva Hevia, Lorna M. Hogg, Gordon W. Honeyman, Robert E. Mulvey Angewandte Chemie International Edition Volume 45, Issue 23, Pages 3775 - 3778 2006 DOI:10.1002/anie.200600720