Bromid fosforitý
Bromid fosforitý (PBr3) je anorganická zlúčenina brómu s fosforom. Ide o jeden z bromidov fosforu. V bežných podmienkach ide o bezfarebnú kvapalinu, ktorá na vzduchu dymí (pretože podlieha hydrolýze vzdušnou vlhkosťou) a intenzívne zapácha. Široko sa používa v laboratóriu pre konverziu alkoholov na alkylbromidy.
| Bromid fosforitý | |||||||||||||||||||||||||||||||||||
 Bromid fosforitý | |||||||||||||||||||||||||||||||||||
 Bromid fosforitý | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | PBr3 | ||||||||||||||||||||||||||||||||||
| Vzhľad | číra, bezfarebná kvapalina s prenikavým zápachom | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 270,7 u | ||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 270,686 g/mol | ||||||||||||||||||||||||||||||||||
| Teplota topenia | −40,5 °C | ||||||||||||||||||||||||||||||||||
| Teplota varu | 173,2 °C | ||||||||||||||||||||||||||||||||||
| Teplota rozkladu | 160 °C | ||||||||||||||||||||||||||||||||||
| Hustota | 3,412 g/cm³ (−79 °C) 2,871 g/cm³ (20,7 °C) | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 20 °C (prudký rozklad) v polárnych rozpúšťadlách: dietyléter alkoholy v nepolárnych rozpúšťadlách: chlorid uhličitý aromatické uhľovodíky | ||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||
| Entropia varu | 143 J/g | ||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −132 kJ/mol (plyn) −177 kJ/mol (kvapalina) | ||||||||||||||||||||||||||||||||||
| Štandardná entropia | 348 J K−1 mol−1 (plyn) | ||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −155,7 kJ/mol (plyn) | ||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,281 J K−1 g−1 (25 °C, plyn) | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 7789-60-8 | ||||||||||||||||||||||||||||||||||
| Číslo UN | 1808 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 232-178-2 | ||||||||||||||||||||||||||||||||||
| Číslo RTECS | TH4460000 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||
Príprava
Bromid fosforitý sa pripravuje pôsobením brómu na červený fosfor. Fosfor musí byť v nadbytku, aby sa zabránilo tvorbe bromidu fosforečného (PBr5):[1]
- P4 + 6Br2 → 4PBr3
Reakcia
Bromid fosforitý, podobne ako chlorid a fluorid fosforitý, má vlastnosti ako Lewisova kyselina aj hydroxid. Napríklad s Lewisovou kyselinou, ako je bromid boritý, tvorí stabilné addukty, napríklad Br3B-PBr3. Súčasne ale môže v mnohých reakciách reagovať ako elektrofil či Lewisova kyselina, napríklad s amínmi.
Najdôležitejšími reakciami bromidu fosforitého sú tie s alkoholmi, kde sa hydroxylová skupina nahrádza atómom brómu a vzniká alkylbromid. Je možné preniesť všetky tri atómy brómu.
- PBr3 + 3ROH → 3RBr + HP(O)(OH)2
Mechanizmus (ukázaný pre primárny alkohol) zahŕňa počiatočnú aktiváciu kyslíkového atómu v molekule alkoholu elektrofilným fosforom (čím vzniká dobrá odstupujúca skupina) a substitúciu SN2 na atóme uhlíka.
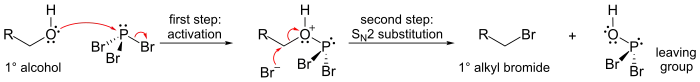
Vzhľadom na substitučné kroky SN2 táto reakcia všeobecne dobre funguje pre primárne a sekundárne alkoholy, ale zlyháva pri terciárnych alkoholov. Ak je reakčné chirálne uhlíkové centrum, reakcia väčšinou invertuje konfiguráciu na alfa uhlíku alkoholu, ako je to pri reakciách SN2 obvyklé.
Podobnou reakciou bromidu fosforitého konvertuje aj karboxylové kyseliny na acylbromidy:
- PBr3 + 3RCOOH → 3RCOBr + HP(O)(OH)2
Bromid fosforitý je pomerne silným redukčným činidlom, oxidácia plynným kyslíkom je omnoho búrlivejšia ako u chloride fosforitom. Reakcia prebieha explozívne za vzniku oxidu fosforečného a brómu.
Použitie
Hlavné použitie bromidu fosforitého je na konverziu primárnych a sekundárnych alkoholov na alkylbromidy,[2] ako je popísané vyššie. Bromid fosforitý obvykle poskytuje vyššiu výťažnosť než kyselina bromovodíková a možno sa vyhnúť problémom s prešmykom karbokatiónu. Napríklad aj neopentylbromid možno získať z alkoholu s výťažnosťou 60%.[3]
Ďalšou oblasťou použitia bromidu fosforitého je katalýza α-bromidácie karboxylových kyselín. Hoci sa acylbromidy vyrábajú v porovnaní s acylchloridmi v oveľa menšej miere, používajú sa ako medziprodukty v Hell-Volhard-Zelinského halogenizácii.[4] Najskôr bromid fosforitý reaguje s karboxylovou kyselinou za vzniku acylbromidu, ktorý je pri bromácii reaktívnejší. Celý proces vyzerá takto:
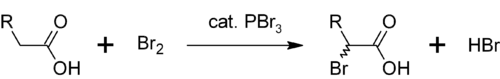
Bromid fosforitý sa využíva tiež pri výrobe liečiv, napríklad alprazolamu, metohexitalu alebo fenoprofénu. Je tiež silným spomaľovačom horenia.
Bezpečnosť
Bromid fosforitý uvoľňuje žieravý bromovodík, je toxický a búrlivo reaguje s vodou a alkoholmi.
V reakciách, kde ako vedľajší produkt vzniká kyselina fosforitá, treba dať pri destilácii pozor na to, že sa táto zlúčenina môže pri teplotách nad cca 160 °C rozkladať za vzniku fosfánu, ktorý môže pri kontakte so vzduchom explodovať.[2]
Podobné látky
- Fluorid fosforitý
- Chlorid fosforitý
- Jodid fosforitý
- Bromid antimonitý
- Bromid arzenitý
- Bromid dusitý
- Bromid fosforečný
- Oxybromid fosforečný
Referencie
- BURTON, Theodore M.; DEGERING, ed. F. The Preparation of Acetyl Bromide. Journal of the American Chemical Society, 1940, čís. 62, s. 227. ISSN 0002-7863. DOI: 10.1021/ja01858a502.
- HARRISON, George C.; DIEHL, H. β-Ethoxyethyl bromide. Organic Syntheses, 1955, čís. 3, s. 370. Dostupné online.
- L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 1051, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
- Norman Neil Greenwood, Alan Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997. ISBN 0-7506-3365-4
- David R. Lide, Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990. ISBN 0-8493-0471-7
- Jerry March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992. ISBN 0-471-60180-2
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- HOLMES, R. R. An Examination of the Basic Nature of the Trihalides of Phosphorus, Arsenic and Antimony. Journal of inorganic and Nuclear Chemistry, 1960, čís. 12, s. 266 – 275. DOI: 10.1016/0022-1902 (60) 80372-7.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Bromid fosforitý na českej Wikipédii.



