Bromid fosforečný
Bromid fosforečný (PBr5) je anorganická zlúčenina a jeden z bromidov fosforu. Za bežných podmienok ide o reaktívnu žltú tuhú látku. V tuhej fáze má štruktúru PBr4+Br-, v plynnej fáze je však úplne disociovaný na bromid fosforitý a bróm. Rýchle ochladenie tejto fázy na 15 kelvinov vedie k vytvoreniu iónov [PBr4]+[Br3]-.
| Bromid fosforečný | |||||||||||||||||||||||||||||||||
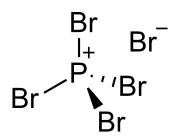 Bromid fosforečný | |||||||||||||||||||||||||||||||||
_bromide.jpg.webp) Bromid fosforečný | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | PBr5 | ||||||||||||||||||||||||||||||||
| Vzhľad | žltooranžový prášok alebo ihličky | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 430,5 u | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 430,494 g/mol | ||||||||||||||||||||||||||||||||
| Teplota rozkladu | 106 °C | ||||||||||||||||||||||||||||||||
| Hustota | 3,574 g/cm³ (−79 °C) | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: prudko reaguje v polárnych rozpúšťadlách: reaguje s alkoholmy v nepolárnych rozpúšťadlách: kvapalné uhľovodíky étrery tetrachlórmetán (chlorid uhličitý) | ||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −285 kJ/mol | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 7789-69-7 | ||||||||||||||||||||||||||||||||
| Číslo UN | 2691 | ||||||||||||||||||||||||||||||||
| EINECS číslo | 232-186-6 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
Bromid fosforečný je možné používať v organickej chémii v konverzii karboxylových kyselín na acylbromidy. Je to silná žieravina a je potrebné s ním zaobchádzať opatrne. Pri teplotách nad 100 °C sa rozkladá na bromid fosforitý a bróm:[1]
- PBr5 → PBr3 + Br2
Obrátenie tohto vzorca pre vytvorenie bromidu fosforečného adíciou brómu s bromidom fosforitým je v praxi ťažké, pretože výsledný produkt je náchylný na ďalšiu adíciu (vzniká tribromid tetrabrómfosfónia [PBr4]Br3).[2]
Referencie
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements, 2nd, Oxford:Butterworth-Heinemann. ISBN 0080379419
- „Spectrophotometric Study of Phosphorus Pentabromide in Various Solvents“(1954). J. Am. Chem. Soc.76(15): 3916–3919. doi:10.1021/ja01644a014
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Bromid fosforečný na českej Wikipédii.

