Bromovodík
Bromovodík (HBrg) je bezkyslíkatá plynná zlúčenina vodíka a brómu s ostrým, nepríjemným zápachom a radí sa medzi halogénvodíky. Pri rozpúšťaní vo vode vzniká kyselina bromovodíková s rovnakým vzorcom. Využíva sa na výrobu niektorých liečiv.
| Bromovodík | |||||||||||||||||||||||||||||||||
 Bromovodík | |||||||||||||||||||||||||||||||||
 Bromovodík | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
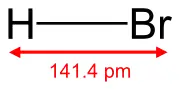
| Sumárny vzorec | HBrg | ||||||||||||||||||||||||||||||||
| Vzhľad | bezfarebný plyn | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 80,91 g/mol | ||||||||||||||||||||||||||||||||
| Teplota topenia | -87 °C, 186 K | ||||||||||||||||||||||||||||||||
| Teplota varu | -66 °C, 207 K | ||||||||||||||||||||||||||||||||
| Hustota | 3,307 kg/m³ | ||||||||||||||||||||||||||||||||
| Rozpustnosť | 193 g/100 ml (pri 20 °C) | ||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | -36,45 až -36,15 kJ/mol | ||||||||||||||||||||||||||||||||
| Štandardná entropia | 198,696 až 198,704 J K-1 mol-1 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 10035-10-6 | ||||||||||||||||||||||||||||||||
| Číslo UN | 1048 | ||||||||||||||||||||||||||||||||
| EINECS číslo | 233-113-0 | ||||||||||||||||||||||||||||||||
| Číslo RTECS | MW3850000 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
Výroba
Priemyselne sa táto látka vyrába reakciou plynného brómu s vodíkom pri teplote medzi 200 a 400 °C. Pri reakcii sa užívajú katalyzátory, zvyčajne platina:
- Br2 + H2 —t, kat→ 2 HBr
Vzniknutý produkt sa následne ochladzuje na oddelenie od nezreagovaného brómu: vzniknutý bromovodík je rozpustený vo vode, pri tom je oddelený nezreagovaný vodík, ktorý sa ďalej zužitkuje.
V laboratórnych podmienkach sa dá vyrábať reakciou bromidu draselného so silnou kyselinou, zvyčajne sírovou:
- 2 KBr + H2SO4 → 2 HBr + K2SO4
Vzniká bromovodík, ktorý sa rýchlo rozpúšťa vo vode, a pri vyparovaní vody sa z nej uvoľňuje.
Pri prebytku kyseliny sírovej dochádza k rozbitiu molekuly bromovodíka na bróm, oxid siričitý a vodu: 2 HBr + H2SO4 → Br2 + SO2 + 2 H2O
Reakcia
Táto látka má svoje použitie v organickej chémii:
Pri reakcii s alkénmi či s alkínmi dochádza k adícii na nenasýtenú väzbu:
- CH2=CH-CH3 + HBr → CH3-CBrH-CH3
S alkínmi reaguje podobne:
- CH≡C-CH + HBr → CH2=CBr-CH3
Ak je dostatok bromovodíka, reakcia pokračuje takto:
- CH2=CBr-CH3 + HBr → CH3-CBr2-CH3
Tieto adície sa riadia Markovnikovovým pravidlom. Bromovodík ako jediný halogénvodík dokáže toto pravidlo prekonať, podmienkou je svetlo a kyslík. Reakcia potom prebieha takto:
- CH2=CH-CH3 + HBr → CH2Br-CH2-CH3
Táto látka reaguje s alkoholmi za vzniku vody a brómderivátov:
- R-OH + HBr → RBr + H2O
V anorganickej chémii sa využíva na výrobu bromidov.
Podobné látky
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Bromovodík na českej Wikipédii.







