Kyselina jantarová
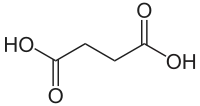
Kyselina jantarová (systematicky kyselina butandiová) je nasycená dikarboxylová kyselina. Má vzorec C4H6O4. Její aniont se nazývá sukcinát (z latinského suc(c)inum - jantar). Název kyseliny pochází od minerálu jantaru (mineralizovaná pryskyřice třetihorních jehličnanů), ve kterém byla objevena.
| Kyselina jantarová | |
|---|---|
 | |
| Obecné | |
| Systematický název | Kyselina butandiová |
| Triviální název | Kyselina jantarová |
| Sumární vzorec | C4H6O4 |
| Identifikace | |
| Registrační číslo CAS | 110-15-6 |
| Vlastnosti | |
| Molární hmotnost | 118,09 g/mol |
| Disociační konstanta pKa | pKa1=4,2 pKa2=5,6 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Kyselina jantarová je nedílnou součástí všech živých organismů a je univerzálním adaptogenem. Vzniká v buňkách člověka, zvířat a rostlin a je zodpovědná za energetický metabolismus. Deficit kyseliny jantarové v lidském těle způsobuje zdravotní problémy, a proto musí být neustále doplňována, zejména při velké fyzické nebo duševním námaze.
Kyselina jantarová se vyskytuje také ve víně, kde vzniká jako vedlejší produkt metabolismu kvasinek během alkoholové fermentace. Příčinou vyšších koncentrací kyseliny jantarové ve víně je nedostatek asimilovatelného dusíku v moštu během fermentace. Bývá označována jako látka zodpovědná za projev terroir ve víně. Projevuje se kamenitou chutí, vysušuje patro a vínu dává až slaný nádech.
Kyselina jantarová se používá například jako léčivo, barvivo a ke změkčování plastů. V potravinářství se využívá ke zvýšení kyselosti a chuti potravin, například v masných výrobcích a nápojích. Je považována za bezpečnou látku bez nežádoucích účinků.
Již faraóni ve starém Egyptě věřili v omlazující moc jantaru, a proto si pod kůži zašívali jantarové destičky. Až do 20. století se léky na bázi kyseliny jantarové a jejích solí používaly při kataru a syfilidě.
Historie

Kyselina jantarová byla objevena v roce 1546 Georgiem Agricolou, který prováděl suchou destilaci jantaru. V roce 1675 Nicolas Lémery jako první rozpoznal kyselou povahu látky a Jöns Jakob Berzelius zjistil její chemické složení (C4H6O4).
Na konci 19. století se gdaňský lékárník Otto Helm pokusil identifikovat původ jantaru na základě obsahu kyseliny jantarové. Zjistil, že pro známý baltský jantar je charakteristický obsah kyseliny jantarové mezi 3,2% a 8,2% .
V roce 1970 Rolf C. A. Rottländer dospěl k závěru, že kyselina jantarová není přirozeně obsažena v jantaru, ale tvoří se v průběhu alkalické hydrolýzy jantaru (jako alkalická sůl) nebo během suché destilace (jako její anhydrid). Navrhl považovat kyselinu jantarovou za přirozený oxidační produkt jantaru a tedy za indikátor jeho procesu stárnutí. Otázka původu a stáří jantaru je i nadále předmětem vědeckého bádání a stále probíhá výzkumu pomocí nejmodernějších metod (infračervená spektroskopie, hmotnostní spektrometrie, plynová chromatografie, nukleární magnetická rezonanční spektroskopie NMR a další).
Výskyt
Přirozeným zdrojem kyseliny jantarové je jantar, fosilní zkamenělina vzniklá z pryskyřice jehličnanů. Obsah kyseliny jantarové je v jantaru podle typu naleziště mezi 3 – 8%.
Kyselina jantarová je přirozenou součástí téměř všech rostlinných a živočišných tkáních. Stejně jako kyselina citronová a kyselina fumarová hraje důležitou roli v metabolických procesech a podílí se na syntéze a rozkladu glukózy, ostatních sacharidů a mastných kyselin.
Kyselina jantarová se také nachází v mnoha rostlinných šťávách (rebarbora, rajčata, brokolice, řepa, chřest, zelí) stejně jako v řasách a houbách. Například sukcinát vápenatý se nachází v nezralém ovoci nebo řasách.
Dále ji obsahují acidofilní mléčné výrobky, tmavý chléb, mořští korýši, víno nebo pivo.
Chemické vlastnosti
Kyselina jantarová je bílá krystalická látka dobře rozpustná ve vodě. Má vzorec HOOC–CH2–CH2–COOH.
Velmi důležité jsou její soli, ve kterých je v karboxylové skupině nahrazen vodík. Nazývají se sukcináty. Obecný vzorec alkalického sukcinátu je MOOC–CH2–CH2–COOM, kde M znamená zejména ionty sodíku a draslíku. Alkalické sukcináty se stejně jako kyselina jantarová dobře rozpouštějí ve vodě, ostatní sukcináty jsou ve vodě nerozpustné.
Také její estery hrají důležitou úlohu v živých organismech. Estery kyseliny jantarové mají vzorec R–O–CO–CH2–CH2–CO–O–R, kde R znamená uhlíkový řetězec. Jsou to sloučeniny, ve kterých je -OH skupina karboxylové kyseliny nahrazena organickým zbytkem vzniklým z alkoholu po odštěpení vodíku z -OH skupiny. Na estery se dá pohlížet také jako na alkoholy, ve kterých je vodík nahrazen acylovou skupinou.
Anhydrid kyseliny jantarové vzniká zahříváním kyseliny jantarové, při kterém se odštěpuje se voda.
Funkce v organismu
V našem organismu se kyselina jantarová vyskytuje především v citrátovém cyklu (Krebsově cyklu). Tento cyklus je velmi důležitá série biochemických reakcí, kdy při odbourávání acetylkoenzymu A za rozkladu sacharidů, lipidů a proteinů vzniká oxid uhličitý a chemicky vázaný vodík.
Kyselina jantarová vzniká z sukcinyl-CoA pomocí sukcinyl-CoA-syntetázy a pomocí sukcinátdehydrogenázy se mění na fumarát. Tyto reakce tak tvoří společnou metabolickou dráhu při aerobní oxidaci sacharidů, lipidů a proteinů.
Kyselina jantarová je zdrojem redukujících látek a tím ovlivňuje oxidaci uvnitř buňky. Stabilizuje strukturu a funkci mitochondrií, působí jako induktor syntézy bílkovin, ovlivňuje pozitivně transport iontů v buňce a transport plynů v organizmu (kyslík a oxid uhličitý).
Vliv na zdraví
Kyselina jantarová má velký vliv na zdraví, neboť se podílí na metabolismu organismů. Přičítají se jí tyto funkce:
- Stimuluje nervový systém, zmírňuje stres a úzkost.
- Zlepšuje buněčné dýchání a metabolismus glukózy.
- Zabraňuje nachlazení, protože pomáhá posilovat imunitní systém.
- Používá se k léčbě artritidy, neboť působí protizánětlivě a jako antioxidant.
- Má pozitivní účinky na srdce, pomáhá předcházet srdečním záchvatům a kardiovaskulárním poruchám.
Výroba
Historicky byla kyselina jantarová získávána z jantaru suchou destilací a byla proto známá jako jantarový destilát. V současnosti se celosvětová produkce odhaduje na 16 000 až 30 000 tun ročně, s ročním tempem růstu 10 %.
Vyrábí se mnoha způsoby, například hydrogenací kyseliny maleinové, oxidací 1,4-butandiolu nebo karbonylací ethylenglykolu. Sukcináty se také vyrábějí z butanu prostřednictvím maleinhydridu.
Vyrábí se také pomocí mikroorganismů fermentací glukózy z kukuřice. Vhodnými mikroorganismy pro výrobu jsou například geneticky modifikované Escherichia coli a Saccharomyces cerevisiae.
Reference
V tomto článku byly použity překlady textů z článků Bernsteinsäure na německé Wikipedii a Succinic acid na anglické Wikipedii.
- Succinic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina jantarová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina jantarová na Wikimedia Commons

