Nitren
Nitreny, také nazývané imeny, jsou sloučeniny s obecným vzorcem R–N, jde o dusíkaté analogy karbenů. Mají jednovazný elektricky neutrální atom dusíku, který má ve své valenční vrstvě 6 elektronů - dva vytvářejí kovalentní vazbu a čtyři jsou nevazebné. V důsledku nesplnění oktetového pravidla jsou tak elektrofilní. Nitreny jsou reaktivními meziprodukty mnoha chemických reakcí.[1][2] Nejjednodušší nitren, NH, bývá nazýván imidogen; tento název se někdy používá jako obecné pojmenování nitrenů.
Elektronová konfigurace
Nejjednodušší nitren N-H (imidogen) má atom dusíku hybridizovaný sp, přičemž dva ze čtyř nevazebných elektronů jsou v orbitalu sp a zbylé dva tvoří degenerovaný pár orbitalů p. Elektronová konfigurace je v souladu s Hundovým pravidlem: nižší energii má triplet s jedním elektronem v každém ze dvou orbitalů p a na vyšší energetické hladině se nachází singlet s jedním orbitalem obsazeným a jedním neobsazeným.
Vznik
Kvůli jejich vysoké reaktivitě obvykle není možné nitreny izolovat; během reakce fungují jako reaktivní meziprodukty. Většinou vznikají jedním z těchto způsobů:
- Termolýzou nebo fotolýzou azidů za uvolnění plynného dusíku. Tento způsob odpovídá tvorbě karbenů z diazosloučenin.
- Z isokyanátů termolýzou za uvolnění oxidu uhelnatého. Tento způsob odpovídá tvorbě karbenů z ketenů.
Reakce
K nejvýznamnějším reakcím nitrenů patří:
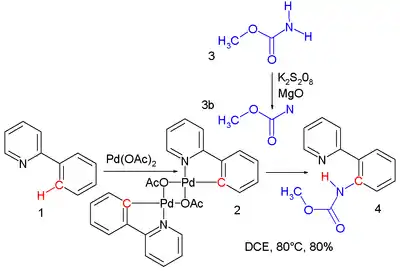
- Tvorba vazby C-H: Nitreny mohou snadno vytvářet nové vazby C-H za vzniku aminů či amidů. Singletový nitren reaguje za zachování stereochemie. Při jedné studii byla provedena reakce nitrenu, vytvořeného oxidací karbamátu peroxodisíranem draselným, s produktem reakce octanu palladnatého s 2-fenylpyridinem za vzniku methyl N-(2-pyridylfenyl)karbamátu.[3]
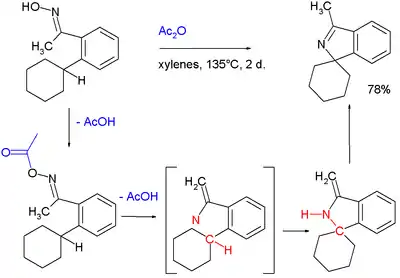
Nitrenové meziprodukty se pravděpodobně utvářejí při reakcích oximů s anhydridem kyseliny octové za vzniku isoindolů:[4]
- Nitrenová cykloadice: Nitreny reagují s alkeny za tvorby aziridinů, často jako meziprodukty vznikají nitrenoidy jako například nosylované nebo tosylované [N-(fenylsulfonyl)imino]fenyljodinany ((C6H5)I=NNs a (C6H5)I=NTs), ovšem při použití sulfonamidů za přítomnosti katalyzátoru obsahujícího přechodný kov, jako například měď, palladium nebo zlato, reagují přímo:[5][6][7][8]
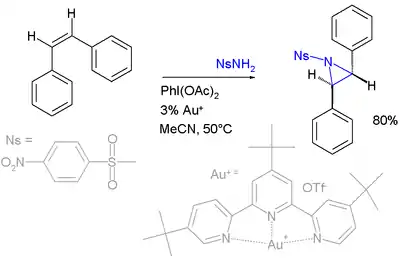
Na následujícím obrázku je zobrazena reakce stilbenu s použitím p-nitrosulfonamidu nebo nosylaminu jako prekurzoru nitrenu oxidovaného (diacetoxyjod)benzenem:
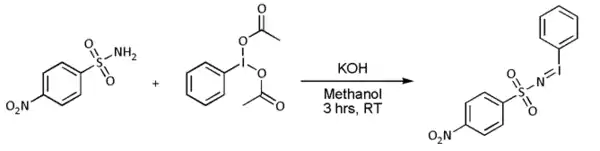
Většinou se však [N-(p-nitrofenylsulfonyl)imino]fenyljodinan připravuje zvlášť:
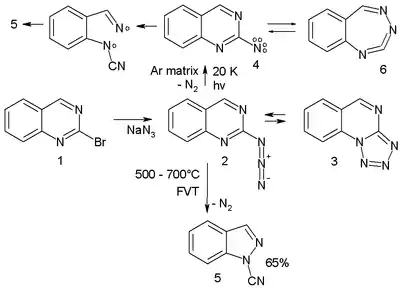
- Arylnitrenové rozšiřování a zkracování cyklů: U arylnitrenů může probíhat rozšiřování aromatického jádra na sedmičlenné cykly, otevírání cyklů a tvorba nitrilů; například azid 2 na obrázku níže zachycený v argonu při 20 K při fotolýze uvolňuje dusík, čímž vzniká tripletový nitren, který je v rovnováze s produktem vznikajícím rozšiřováním cyklu 6.
Nitren se přeměňuje na nitril 5 přes biradikál 7. Při termolýze za teploty 500 až 600 °C se také tvoří tento nitril, a to s 65% výtěžností. Chinazolin použitý při reakci se připravuje z příslušného bromidu a z azidu sodného. Azid je v rovnováze s tetrazolem 3.
Nitrenové radikály
U některých radikálů obsahujících nitrenové skupiny byly pozorovány vysokospinové kvartety; jeden z nich obsahoval aminoxidovou radikálovou skupinu[9] a druhý uhlíkatý radikál.[10]
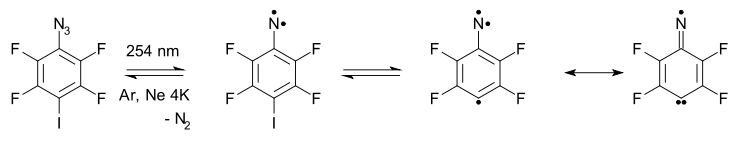
V tomto systému je jeden z nepárových elektronů na dusíkovém atomu delokalizován na aromatickém kruhu a ze sloučeniny se tak stává σ–σ–π triradikál. Celkovou elektronovou strukturu také ovlivňuje rezonanční struktura dusíkatého karbenového radikálu.
V roce 2019 byl izolován tripletový nitren stabilizovaný vazbou na měď v objemném ligandu.[11]
Reference
V tomto článku byl použit překlad textu z článku Nitrene na anglické Wikipedii.
- Nitrenes. Příprava vydání W. Lwowski. New York: Interscience, 1970.
- C. Wentrup. Reactive Intermediates. New York: Wiley, 1984.
- Hung-Yat Thu; Wing-Yiu Yu; Chi-Ming Che. Intermolecular Amidation of Unactivated sp2 and sp3 C–H Bonds via Palladium-Catalyzed Cascade C–H Activation/Nitrene Insertion. Journal of the American Chemical Society. 2006, s. 9048–9049. DOI 10.1021/ja062856v. PMID 16834374.
- Cécile G. Savarin; Christiane Grisé; Jerry A. Murry; Robert A. Reamer. Novel Intramolecular Reactivity of Oximes: Synthesis of Cyclic and Spiro-Fused Imines. [s.l.]: [s.n.], 2007. DOI 10.1021/ol0630043. PMID 17319674. S. 981–983.
- Zigang Li; Xiangyu Ding; Chuan He. Nitrene Transfer Reactions Catalyzed by Gold Complexes. The Journal of Organic Chemistry. 2006, s. 5876–5880. Dostupné online. DOI 10.1021/jo060016t.
- David A. Evans; Margaret M. Faul; Mark T. Bilodeau. Development of the Copper-Catalyzed Olefin Aziridination Reaction. Journal of the American Chemical Society. 1994, s. 2742–2753. Dostupné online. DOI 10.1021/ja00086a007.
- Peter Brandt; Mikael J. Sodergren; Pher G. Andersson; Per-Ola Norrby. Mechanistic Studies of Copper-Catalyzed Alkene Aziridination. Journal of the American Chemical Society. 1994, s. 8013–8020. Dostupné online. DOI 10.1021/ja993246g.
- Iain D. G. Watson; Lily Yu; Andrei K. Yudi. Advances in Nitrogen Transfer Reactions Involving Aziridines. Accounts of Chemical Research. 2006, s. 194–206. Dostupné online. DOI 10.1021/ar050038m. PMID 16548508.
- Paul M. Lahti; Burak Esat; Yi Liao; Paul Serwinski; Jiang Lan; Richard Walton. Heterospin organic molecules: nitrene–radical linkages. Polyhedron. 2001-05-30, s. 1647–1652. DOI 10.1016/S0277-5387(01)00667-2.
- Wolfram Sander; Dirk Grote; Simone Kossmann; Frank Neese. 2,3,5,6-Tetrafluorophenylnitren-4-yl: Electron Paramagnetic Resonance Spectroscopic Characterization of a Quartet-Ground-State Nitreno Radical. Journal of the American Chemical Society. 2001-05-30, s. 4396–4403. DOI 10.1021/ja078171s. PMID 18327939.
- Synthesis of a Copper-Supported Triplet Nitrene Complex Pertinent to Copper-Catalyzed Amination. Science. 2019, s. 1138–1143. DOI 10.1126/science.aax4423. PMID 31515388.