Tetrazol
Tetrazol je heterocyklická organická sloučenina s pětičlenným cyklem obsahujícím čtyři atomy dusíku a jeden atom uhlíku; jako tetrazoly se také označují deriváty této základní sloučeniny.
| Tetrazol | |
|---|---|

Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | tetrazol |
| Ostatní názvy | 1H-tetrazol, tetraazacyklopentadien |
| Sumární vzorec | CH2N4 |
| Vzhled | bezbarvý až nažloutlý krystalický prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 288-94-8 |
| EC-no (EINECS/ELINCS/NLP) | 206-023-4 |
| PubChem | 67519 |
| ChEBI | 33193 |
| SMILES | C1=NNN=N1 |
| InChI | 1S/CH2N4/c1-2-4-5-3-1/h1H,(H,2,3,4,5) |
| Vlastnosti | |
| Molární hmotnost | 70,053 g/mol |
| Teplota tání | 157 °C (497 až 501 K)[1] |
| Hustota | 1,34 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H201 H272[1] |
| P-věty | P210, P220, P221, P230, P240, P250, P280, P370+378, P370+380, P372, P373, P401 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
Existují tři izomery tetrazolu, lišící se polohou dvojných vazeb: 1H-, 2H-, a 5H-tetrazol. 1H- a 2H-izomery jsou navzájem tautomery, přičemž v pevném skupenství převažuje 1H-tetrazol.[2][3][4] V plynném skupenství je oproti tomu většinovým tautomerem 2H-tetrazol.[3][5][6]
1H- a 2H-tetrazol jsou aromatické, protože mají 6 π elektronů; 5H-izomer aromatický není.
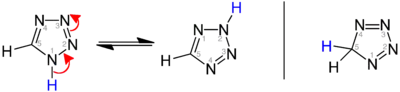
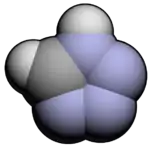
Příprava
1H-tetrazol byl poprvé připraven reakcí bezvodé kyseliny azidovodíkové s kyanovodíkem za zvýšeného tlaku. Reakcemi nitrilů s azidem sodným za přítomnosti jodu nebo hydrogensíranu sodného na silikagelu jako katalyzátorů lze výhodně připravit 5-substitované 1H-tetrazoly. Dalším možným způsobem je deaminace 5-aminotetrazolu, jenž se dá zakoupit nebo získat z aminoguanidinu.[7][8]
2-aryl-2H-tetrazoly mohou být připraveny [3+2] cykloadičními reakcemi aryldiazoniových solí a trimethylsilyldiazomethanu.[9]
Použití
Existuje několik léčiv obsahujících tetrazolovou funkční skupinu. Tetrazoly mohou fungovat jako bioizostery pro karboxylátové skupiny, protože mají podobné hodnoty pKa a jsou deprotonovány za fyziologického pH. Blokátory receptoru angiotenzinu II — například losartan a kandesartan, jsou často tetrazoly.
Často používaným tetrazolem je dimethylthiazolyldifenyltetrazolium bromid (MTT). Tento tetrazol se používá při MTT testech ke kvantifikaci respirační aktivity živých buněk v tkáňových kulturách, i když je obvykle zabíjí. Některé tetrazoly mohou být rovněž použity k detekci DNA.[10]
Bylo zjištěno, že VT-1161 a VT-1129mohou být použity proti houbovým chorobám, protože narušují funkci houbových enzymů, ale na lidské nepůsobí.[11][12]
Některé vysokoenergetické deriváty tetrazolu, například azidotetrazolátové soli dusíkatých zásad, byly zkoumány jako možné vysokoúčinné výbušniny, jež by mohly nahradit trinitrotoluen (TNT), a také jako pevná paliva pro raketové motory.[13][14]
Výbušné vlastnosti se využívají také u samotného tetrazolu a 5-aminotetrazolu, jenž se někdy používají k tvorbě plynu v airbazích. Tetrazolové energetické materiály vytvářejí za vysokých teplot netoxické produkty, jako jsou voda a dusík,[15] hoří rychle a jsou poměrně stabilní.[16]
Delokalizační energie tetrazolu je 209 kJ/mol.
1H-tetrazol a 5-(benzylthio)-1H-tetrazole (BTT) se používají jako kyselé aktivátory reakcí při syntéze oligonukleotidů.[17]
Odkazy
Související články
- Triazol
- Pentazol
- Oxatetrazol
- Thiatetrazol
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrazol na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrazol na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Tetrazole na anglické Wikipedii.
- 1H-Tetrazole. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- R. Goddard; O. Heinemann; C. Krüger. α-1H-1,2,3,4-Tetrazole. Acta Crystallographica Section C. 1997-05-15, s. 590–592. Dostupné online. ISSN 0108-2701. DOI 10.1107/S0108270197000772.
- Vitaly G. Kiselev; Pavel B. Cheblakov; Nina P. Gritsan. Tautomerism and Thermal Decomposition of Tetrazole: High-Level ab Initio Study. The Journal of Physical Chemistry A. 2011-03-10, s. 1743–1753. Dostupné online. ISSN 1089-5639. DOI 10.1021/jp112374t.
- Razynska, A.; Tempczyk, A.; Malinski, E.; Szafranek, J.; Grzonka, Z.; Hermann, P.: in J. Chem. Soc. Perkin Trans. 2 1983, 379.
- Ming Wah Wong; Regis Leung-Toung; Curt Wentrup. Tautomeric equilibrium and hydrogen shifts of tetrazole in the gas phase and in solution. Journal of the American Chemical Society. 1993-03-01, s. 2465–2472. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00059a048.
- Anna Rażyńska; Anna Tempczyk; Edmund Maliński; Janusz Szafranek; Zbigniew Grzonka; Peter Hermann. Application of mass spectrometry to the study of prototropic equilibria in 5-substituted tetrazoles in the gas phase; experimental evidence and theoretical considerations. Journal of the Chemical Society, Perkin Transactions 2. 1983-01-01, s. 379–383. Dostupné online. ISSN 1364-5471. DOI 10.1039/P29830000379.
- Ronald A. Henry; William G. Finnegan. An Improved Procedure for the Deamination of 5-Aminotetrazole. Journal of the American Chemical Society. 1954-01-01, s. 290–291. ISSN 0002-7863. DOI 10.1021/ja01630a086.
- F. Kurzer; L. E. A. Godfrey. Syntheses of Heterocyclic Compounds from Aminoguanidine. Angewandte Chemie International Edition in English. 1963, s. 459–476. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.196304591.
- Remi Patouret; Theodore M. Kamenecka. Synthesis of 2-aryl-2H-tetrazoles via a regioselective [3+2] cycloaddition reaction. Tetrahedron Letters. 2016-04-06, s. 1597–1599. DOI 10.1016/j.tetlet.2016.02.102. PMID 27041776.
- S. Berner; K. Mühlegger; H. Seliger. Studies on the role of tetrazole in the activation of phosphoramidites. TNucleic Acids Research. 1989-02-11, s. 853–864. DOI 10.1093/nar/17.3.853. PMID 2922273.
- A. G. S. Warrilow, C. M. Hull, J. E. Parker, E. P. Garvey, W. J. Hoekstra, W. R. Moore, R. J. Schotzinger, D. E. Kelly, S. L. Kelly. The Clinical Candidate VT-1161 Is a Highly Potent Inhibitor of Candida albicans CYP51 but Fails To Bind the Human Enzyme. Antimicrobial Agents and Chemotherapy. 2014, s. 7121–7127. DOI 10.1128/AAC.03707-14. PMID 25224009.
- Shawn R. Lockhart, Annette W. Fothergill, Naureen Iqbal, Carol B. Bolden, Nina T. Grossman, Edward P. Garvey, Stephen R. Brand, William J. Hoekstra, Robert J. Schotzinger, Elizabeth Ottinger, Thomas F. Patterson, Nathan P. Wiederhold. The Investigational Fungal Cyp51 Inhibitor VT-1129 Demonstrates Potent Activity against Cryptococcus neoformans and Cryptococcus gattii. Antimicrobial Agents and Chemotherapy. 2016, s. 2528–2531. DOI 10.1128/AAC.02770-15. PMID 26787697.
- Greener explosives show promise [online]. Chemistry World, 2008-10-02. Dostupné online.
- Niko Fischer; Konstantin Karaghiosoff; Thomas M. Klapötke; Jörg Stierstorfer. New Energetic Materials featuring Tetrazoles and Nitramines – Synthesis, Characterization and Properties. Zeitschrift für Anorganische und Allgemeine Chemie. 2010, s. 735–749. DOI 10.1002/zaac.200900521.
- Tore Brinck; Thomas M. Klapötke; Jörg Stierstorfer. Energetic Tetrazole N -oxides. Green Energetic Materials. 2014, s. 133–178. ISBN 9781118676448. DOI 10.1002/9781118676448.ch06.
- Nicholas Piekiel; Michael R. Zachariah. Decomposition of Aminotetrazole Based Energetic Materials under High Heating Rate Conditions. The Journal of Physical Chemistry A. 2012, s. 1519–1526. DOI 10.1021/jp203957t. PMID 22214278. Bibcode 2012JPCA..116.1519P.
- Xia Wei. Coupling activators for the oligonucleotide synthesis via phosphoramidite approach. Tetrahedron. 2013-05-06, s. 3615–3637. DOI 10.1016/j.tet.2013.03.001.