Azid sodný
Azid sodný je pevná bezbarvá až bílá krystalická látka velmi dobře rozpustná ve vodě.
| Azid sodný | |
|---|---|
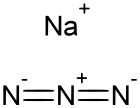 | |
 | |

Azid sodný (krystaly) | |
| Obecné | |
| Systematický název | Azid sodný |
| Anglický název | Sodium azide |
| Německý název | Natriumazid |
| Sumární vzorec | NaN3 |
| Vzhled | Pevná bezbarvá až bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 26628-22-8 |
| EC-no (EINECS/ELINCS/NLP) | 247-852-1 |
| Indexové číslo | 011-004-00-7 |
| UN kód | 1687 |
| Číslo RTECS | VY8050000 |
| Vlastnosti | |
| Molární hmotnost | 65,011 g/mol |
| Teplota rozkladu | 275 °C |
| Hustota | 1,847 g/cm3 |
| Rozpustnost ve vodě | 41,7 g/100 ml (17 °C) |
| Relativní permitivita εr | 5,98 |
| Měrná magnetická susceptibilita | −3,29×10−6 cm3 g−1 |
| Struktura | |
| Krystalová struktura | šesterečná |
| Hrana krystalové mřížky | a= 363,8 pm c= 1 520,1 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 21,26 kJ/mol |
| Standardní slučovací Gibbsova energie ΔGf° | 99,46 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H300 H310 H330 H373 H410
EUH032 |
| P-věty | P273 P280 P301+310 P302+352 P310 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |

Při teplotách nad 275 °C se rozkládá, nad 300 °C může mít rozklad explozivní charakter za vzniku jedovatých a leptavých nitrózních plynů, nad 309 °C hrozí samovznícení.
Vlastnosti
- Azid sodný je poměrně stálý, dá se bez rozkladu tavit.
- Pokud se NaN3 dostane do styku s mědí nebo olovem, může vést k tvorbě explozivních nebo toxických sloučenin.
- Při styku se silnými kyselinami se uvolňuje vysoce toxická a výbušná kyselina azidovodíková za značného vývinu tepla.[2]
Toxikologie
Azid sodný je velice toxická látka. Dráždí oči, sliznice i kůži, v případě vdechování dráždí dýchací cesty a jejich sliznice. Při požití závažně dráždí sliznice úst, hltanu, trávicího traktu. Akutní otrava se projevuje na CNS. Již nepatrné dávky azidu sodného vyvolávají roztažení periferních cév, pokles krevního tlaku, kašel, křeče, dušnost, nevolnost, zvracení i bezvědomí.
Při opakované nebo prodloužené expozici azid sodný poškozuje CNS - demyelinizuje nervová vlákna.
Použití
- Azid sodný je nejdůležitějším azidem, z něhož se připravují ostatní azidy.
- Azid sodný se využívá jako biocid v nemocnicích a laboratořích pro uchovávání zásobních roztoků náchylných k bakteriální a plísňové kontaminaci. Azid sodný blokuje růst mikroorganismů inhibicí cytochrom oxidázy.
- Snadného rozkladu azidu sodného se využívá při konstrukci automobilových airbagů. Při nárazu automobilu je elektricky odpáleno přesně dávkované množství azidu sodného, který se rozkládá podle rovnice:
- 2 NaN3 → 2 Na + 3 N2. Jeden generátor airbagu obsahuje desítky gramů azidu sodného. V moderních automobilech se od jeho používání upouští.
Vzniklý dusík okamžitě naplní airbag, zatímco kovový sodík je přeměněn reakcí s dusičnanem draselným (KNO3) a oxidem křemičitým (SiO2) na bezpečnou formu silikátového „skla“.
Reference
- Sodium azide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Sodium azide - ICSC
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.


