Areny
Areny, či starším názvem aromatické uhlovodíky, jsou uhlovodíky, které splňují pravidla aromaticity: mají delokalizovaný systém π-elektronů v planární, tj.rovinné, cyklické molekule. Většinou mají charakteristický zápach (odtud jejich starší název), ovšem není to jejich charakteristický znak.
Struktura
Dříve se vědci domnívali, že struktura benzenu odpovídá kruhové molekule s pravidelným střídáním jednoduchých a dvojných vazeb (jednalo by se tedy o cyklohexa-1,3,5-trien). Nyní je známo, že díky dokonalé delokalizaci π-elektronů charakter jednoduchých a dvojných vazeb zaniká. Délka vazby v benzenu je 139 pm oproti 154 pm jednoduché a 134 pm dvojné vazby.[1] Areny proto mají zvláštní chemické vlastnosti, zejména poměrnou stálost benzenového kruhu a naopak reaktivnost skupin vázaných na benzenový kruh.
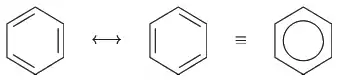
Dělení
- monocyklické – obsahují pouze jeden aromatický kruh (např. benzen)
- polycyklické – obsahují více aromatických kruhů
Názvosloví
Vzhledem k odlišnému charakteru arenů od běžných cykloalkenů se systematické názvosloví používá zřídka. Většina základních arenů má svoje triviální názvy.
Vlastnosti
Benzen, toluen a xyleny jsou kapaliny, vyšší areny jsou pevné látky (naftalen sublimuje). Vzhledem k charakteru vazeb patří areny mezi nepolární sloučeniny, rozpouští se v nepolárních rozpouštědlech, ve vodě nikoliv. Většinou mají charakteristický zápach a menší hustotu než voda. Areny jsou vesměs hořlavé, některé jsou jedovaté (při požití nebo vdechnutí). U řady z nich byly prokázány karcinogenní účinky.
Příprava
- Dehydrogenace cykloalkanů a cykloalkenů
- Dekarboxylace solí příslušných aromatických karboxylových kyselin zahříváním s příslušným hydroxidem
- Trimerací acetylenu lze připravit benzen.
Reakce arenů
Reakce na bočním řetězci probíhají podobně jako u alifatických uhlovodíků. Navíc je při radikálové substituci zvýhodněn atom uhlíku napojující se bezprostředně na benzenové jádro. Adice probíhá na nenasycených postranních řetězcích. Oxidací můžeme připravit aromatické karboxylové kyseliny.
Protože charakter jednoduchých a dvojných vazeb zanikl, jsou aromatická jádra (na rozdíl od nenasycených uhlovodíků) odolnější vůči adicím. Typickou reakcí arenů je elektrofilní substituce (např. nitrace). Jsou ovšem známé i reakce s radikálovým principem. Mezi ně patří i oxidace jádra vedoucí k chinonům.
Základní zástupci arenů
- Benzen (C6H6) je bezbarvá, hořlavá, jedovatá, zapáchající kapalina s teplotou varu 80 °C. Má rakovinotvorné účinky a její páry jsou na vzduchu výbušné. Používá se jako nepolární rozpouštědlo (např. tuků a olejů). Slouží k výrobě léčiv, plastů, výbušnin, pesticidů, barviv a dezinfekčních přípravků.
- Naftalen (C10H8, 2 benzenové kruhy) je bílá krystalická, charakteristicky páchnoucí látka, schopná sublimace (přechodu z pevného skupenství na plynné). Připravuje se z černouhelného dehtu vznikajícího při karbonizaci uhlí. Slouží k výrobě přípravků proti molům, barviv, monomerů (kyselina ftalová), plastů, dezinfekce. Lze hydrogenovat na tetralin a dekalin.
- Toluen (C6H5CH3) je bezbarvá, zdraví škodlivá kapalina. Se vzduchem tvoří výbušnou směs. Je návyková, při vdechování poškozuje dýchací cesty a centrální nervovou soustavu. Slouží k výrobě barviv, laků, plastů, výbušnin (TNT) a umělého sladidla sacharinu. Používá se také jako rozpouštědlo.
- Xyleny (C6H4(CH3)2), polohové izomery) jsou kapaliny používané jako rozpouštědla. Vyrábí se z nich syntetická vlákna a aromatické dikarboxylové kyseliny.
- Styren (C6H5CH=CH2) je bezbarvá až nažloutlá kapalina s pronikavě nasládlým zápachem. Za běžné teploty působením světla rosolovatí. Připravuje se alkylací benzenu a následnou dehydrogenací. Slouží k výrobě polystyrenu, barviv, plastů a syntetického kaučuku v gumárenském průmyslu.
Výskyt
Zdrojem arenů jsou černouhelný dehet a ropa (zvláště z Blízkého východu).
Reference
- Organická chemie I - Uhlovodíky [online]. [cit. 2013-06-09]. Dostupné online.[nedostupný zdroj]
- Červinka O., Dědek V., Ferles M.: Organická chemie, druhé přepracované vydání, SNTL, Praha
Externí odkazy
 Obrázky, zvuky či videa k tématu areny na Wikimedia Commons
Obrázky, zvuky či videa k tématu areny na Wikimedia Commons