Formamid
Formamid nebo methanamid je amid odvozený od kyseliny mravenčí, lze jej také považovat za aldehyd kyseliny karbamové. Je to čirá kapalina mísitelná s vodou, se zápachem podobným jako u amoniaku. Je výchozí surovinou ve výrobě sulfonamidů a ostatních léčiv, pesticidů a kyseliny kyanovodíkové. Používá se ke změkčování papíru. Rozpouští mnoho iontových sloučenin, pryskyřic a plastifikátorů.[3]
| Formamid | |
|---|---|
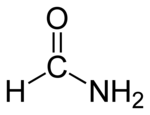
Strukturní vzorec | |
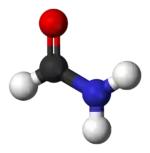
Kuličkový model molekuly | |
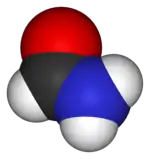
Kalotový model molekuly | |
| Obecné | |
| Systematický název | Methanamid |
| Ostatní názvy | Karbamaldehyd |
| Anglický název | Formamide |
| Německý název | Formamid |
| Funkční vzorec | CHONH2 |
| Sumární vzorec | CH3NO |
| Vzhled | bezbarvá olejovitá kapalina |
| Identifikace | |
| Registrační číslo CAS | 75-12-7 |
| PubChem | 713 |
| ChEBI | 48431 |
| SMILES | O=CN |
| InChI | 1/CH3NO/c2-1-3/h1H,(H2,2,3) |
| Vlastnosti | |
| Molární hmotnost | 45,041 g/mol |
| Teplota tání | 2–3 °C (275–276 K) |
| Teplota varu | 210 °C (483 K) (částečný rozklad) |
| Hustota | 1,133 g/cm3 |
| Disociační konstanta pKa | 23,5 (v DMSO[1]) |
| Rozpustnost ve vodě | mísitelný |
| Tlak páry | 10,7 Pa (20 °C) |
| Měrná magnetická susceptibilita | 4,86×105 μm3/g |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| Teplota vzplanutí | 154 °C (427 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Formamid se při teplotě 180 °C částečně rozkládá na oxid uhelnatý a amoniak, přičemž také vznikají malá množství kyanovodíku a vody. Za přítomnosti kyseliny v pevném skupenství jako katalyzátoru vzniká více HCN:
- nízká teplota: HC(O)NH2 → CO + NH3
- vysoká teplota, katalyzováno kyselinou: HC(O)NH2 → HCN + H2O
Výroba
V minulosti
Dříve se formamid vyráběl reakcí kyseliny mravenčí s amoniakem, čímž vznikal mravenčan amonný, který se poté zahřátím přeměnil na formamid[4]:
- HCOOH + NH3 → HCOONH4
- HCOONH4 → HCONH2 + H2O
Moderní výroba
Současná průmyslová výroba formamidu se skládá z jediné reakce, karbonylaci amoniaku[3]:
- CO + NH3 → HCONH2
Formamid může být vyroben rovněž dvoustupňovým procesem zahrnujícím amonolýzu mravenčanu methylnatého, který se získá z oxidu uhelnatého a methanolu:
- CO + CH3OH → HCOOCH3
- HCO2CH3 + NH3 → HC(O)NH2 + CH3OH
Ostatní
Formamid lze též získat aminolýzou mravenčanu ethylnatého[5]:
- HCOOCH2CH3 + NH3 → HCONH2 + CH3CH2OH
Použití
Formamid se používá na výrobu kyanovodíku a jako rozpouštědlo při zpracovávání nejrůznějších polymerů jako je například polyakrylonitril.
Laboratorní a ostatní využití
Formamid je složkou ochranných směsí používaných při kryokonzervaci tkání a orgánů.
Tato látka se také používá jako stabilizér RNA v gelové elektroforéze, kde má za úkol deionizovat RNA. V kapilární elektroforéze se používá ke stabilizaci (jednotlivých) vláken denaturované DNA.
Další využití nachází jako přísada v sol-gelových roztocích, kde zabraňuje prasknutí během spékání.
Čistý formamid se používá jako alternativní rozpouštědlo pro elektrostatické samouspořádávání polymertových nanofilmů.[6]
Formamid je rovněž používán na přímou přípravu primárních aminů z ketonů přes jejich N-formylderiváty Leuckartovou reakcí.
Vznik života
Bylo zjištěno, že formamid zahřátý na 130 °C se v přítomnosti ultrafialového záření přeměňuje na guanin.[7] S formamidem jako základním stavebním kamenem počítají některé hypotézy vzniku života.[8]
Bezpečnost
Formamid je mírně dráždivý pro oči, kůži a sliznice.[9] Vdechnutí většího množství par této látky vyžaduje lékařské ošetření.[10][11] Má také teratogenní účinky.[12] U formamidu byla prokázána hematotoxicita pro zvířata, tato látka je nebezpečná při delší expozici vdechnutím, pozřením a absorpcí skrz kůži.[13] Nikdy by s ním nemělo být manipulováno bez odpovídajících ochranných pomůcek jako jsou rukavice a ochranné brýle.
Reference
V tomto článku byl použit překlad textu z článku Formamide na anglické Wikipedii.
- F. G. Bordwell; J. E. BARTMESS; J. A. HAUTALA. Alkyl effects on equilibrium acidities of carbon acids in protic and dipolar aprotic media and the gas phase. J. Org. Chem.. 1978, s. 3095–3101. DOI 10.1021/jo00410a001. (anglicky)
- Formamide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- HOHN, A. Kirk-Othmer Concise Encylclopedia of Chemical Technology. Redakce Kroschwitz Jacqueline I.. 4th. vyd. New York: John Wiley & Sons, Inc., 1999. ISBN 978-0471419617. Kapitola Formamide, s. 943–944. (anglicky)
- LORIN, M. Preparation of Formamide by means of Formiates and Oxalates. The Chemical News and Journal of Physical Science. 1864, s. 291. Dostupné online [cit. 14 June 2014]. (anglicky)
- PHELPS, I.K.; DEMING, C.D. The Preparation of Formamide from Ethyl Formate and Ammonium Hydroxide. The Chemical News and Journal of Physical Science. 1908, s. 86–87. Dostupné online [cit. 14 June 2014]. (anglicky)
- Vimal K. Kamineni; YURI M. LVOV; TABBETHA A. DOBBINS. Layer-by-Layer Nanoassembly of Polyelectrolytes Using Formamide as the Working Medium. Langmuir. 2007, s. 7423–7427. DOI 10.1021/la700465n. PMID 17536845. (anglicky)
- Origin of Life: Adding UV Light Helps Form 'Missing G' of RNA Building Blocks [online]. Science Daily, June 14, 2010. Dostupné online. (anglicky)
- Jak vznikl život? Vše již bylo objeveno před 64 lety!. astro.cz [online]. Česká astronomická společnost, 2017-04-17 [cit. 2017-11-02]. Dostupné online.
- TOXNet Formamide HSDB: Formamide
- Warheit DB1, Kinney LA, Carakostas MC, Ross PE. Inhalation toxicity study of formamide in rats. Toxicological Sciences. 1989, s. 702–713. DOI 10.1093/toxsci/13.4.702. PMID 2620791. (anglicky)
- MSDS for formamide, hazard.com
- Lab use of formamide Archivováno 14. 10. 2009 na Wayback Machine, University of Bath
- Archivováno 10. 7. 2015 na Wayback Machine ECHA Formamide
