Dipólový moment
Dipólový moment (přesněji elektrický dipólový moment) je vektorová veličina popisující nesymetrické rozdělení elektrického náboje, např. v molekule nebo v malé skupině atomů.
Výpočet
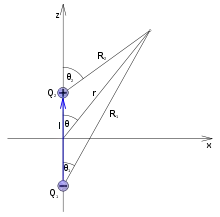
V nejjednodušším případě, kdy dva bodové náboje s opačným znaménkem +q a -q jsou umístěny ve vzájemné vzdálenosti d, je velikost dipólového momentu této dvojice nábojů rovna
- ,
přičemž směr vektoru elektrického dipólového momentu leží na spojnici bodových nábojů.
Pokud se elektrický náboj nachází v bodě s polohovým vektorem a náboj v bodě s polohovým vektorem , lze jejich vzájemnou polohu charakterizovat vektorem . Elektrický dipólový moment pak lze vyjádřit jako
Je-li elektrický náboj v prostoru rozložen s hustotou , přičemž celkový elektrický náboj je nulový, tzn.
- ,
kde integrace probíhá přes celý zkoumaný objem , pak elektrický dipólový moment má hodnotu
Vlastnosti
Podle hodnoty dipólového momentu chemie rozlišuje polární (voda, NaCl,...) a nepolární molekuly (CO2, benzen,...). Polární molekuly mají stálou a nenulovou hodnotu elektrického dipólového momentu, tvoří permanentní dipól, nepolární ho mají nulový. Tato vlastnost je důležitá pro určení rozpustnosti v rozpouštědlech.
Související články
- Elektrický dipól
- Magnetický dipólový moment
- Multipólový moment