Hydroboračně-oxidační reakce
Hydroboračně–oxidační reakce je dvoukroková hydratační reakce, při níž se alkeny mění na alkoholy.[1]
Dochází přitom k syn-adici vodíku a hydroxylové skupiny na místo, kde se nacházela dvojná vazba. Hydroborace–oxidace probíhají proti Markovnikovovu pravidlu, hydroxyl se navazuje na méně substituovaný uhlík. Reakce je tak stereospecifičtější a regiochemicky pravidelnější obdobou jiných hydratačních reakcí, jako jsou kysele katalyzovaná adice a oxymerkurace-redukce. Hydroborace-oxidace objevil Herbert C. Brown v 50. letech 20. století,[2] za což v roce 1979 obdržel Nobelovu cenu za chemii.
Obecný průběh reakce je znázorněn na tomto obrázku:
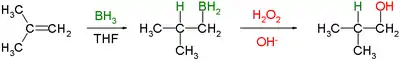
Nejčastějším rozpouštědlem při hydroboračně-oxidačních reakcích je tetrahydrofuran (THF).
Mechanismus a rozsah
Hydroborační krok
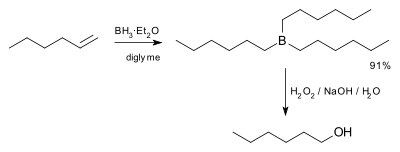
V prvním kroku se boran (BH3) naváže na dvojnou vazbu, přičemž se jeden z vodíkových atomů přesune na uhlík sousedící s tím, na který je navázán bor. Tato hydroborace se ještě dvakrát zopakuje, čímž zreaguje každá vazba B-H a na každou molekulu BH3 se navážou tři alkeny. Vzniklý trialkylboran v druhém kroku reaguje s peroxidem vodíku, což vede k náhradě vazeb B-C vazbami HO-C. Boran se přitom mění na kyselinu boritou. Reakci popsal Herbert C. Brown v roce 1957 jako přeměnu hex-1-enu na hexan-1-ol.[3]
S využitím možnosti nahradit bor ve funkční skupině hydroxylem lze určit, že regioselektivitu vytváří původní hydroborační krok. Hydroborace probíhá proti Markovnikovovu pravidlu. Reakce je také stereospecifická, dochází k syn-adici (na shodných stranách alkenu): hydroborace je syn-selektivní a oxidace nahrazuje bor hydroxylem na stejné pozici; 1-methylcyklopenten tak reaguje s diboranem převážně na trans-1-hydroxy-2-methylcyklopentan[4]— nově navázaný vodík a hydroxyl jsou navzájem v poloze cis.
Po odstranění všech vodíků navázaných na bor se skupina BH2 váže na další alkeny, jeden mol hydroboranu tak reaguje se třemi moly alkenu. Není nutné, aby hydroboran měl více než jeden atom vodíku, například se často používají reaktanty typu R2BH, kde R mohou být organické skupiny. K takovýmto hydroboračním činidlům patří například 9-borabicyklo[3.3.1]nonan, katecholboran a disiamylboran.
Hydroborace alkynů
Hydroborace lze také provést u alkynů. I v tomto případě probíhá syn-adice a vedlejšími produkty jsou aldehydy při použití koncových a ketony u vnitřních alkynů. Za účelem zamezení hydroborace obou vazeb pí a se používají borany s objemnými substituenty, například disiamyl [(di-sek-iso-amyl)boran].[5]
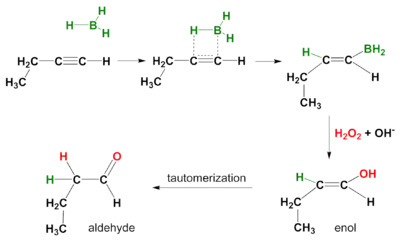
Oxidační krok
V druhé části reakční posloupnosti atakuje nukleofilní hydroperoxidový anion atom boru. Přesun alkylu na kyslík vede ke vzniku alkylboranu se zachováním stereochemie (ve skutečnosti reakce probíhá přes trialkylborát B(OR)3 místo monoalkylborinového esteru BH2OR).

Atom 'H' při reakci pochází z B2H6, atom 'O' z peroxidu vodíku (H2O2) a na O navázaný 'H' z rozpouštědla.
Jiné možnosti oxidace
Použití jiného oxidačního činidla než peroxidu vodíku vede u alkenů k tvorbě karbonylových sloučenin místo alkoholů. N-methylmorfolin N-oxid s ruthenistanem tetrapropylamonným přeměňuje alkylborany na karbonylové sloučeniny a vytváří se tak, v závislosti na dalších skupinách navázaných na příslušný uhlík v použitém alkenu, keton nebo aldehyd.[6]
Na přípravu ketonů z vnitřních alkenů lze také použít dichromany a jiné chromové sloučeniny, které ovšem z koncových alkenů vytvářejí karboxylové kyseliny místo aldehydů.[7]
Odkazy
Externí odkazy
- Organic Chemistry Portal. Hydroboration https://www.organic-chemistry.org/namedreactions/brown-hydroboration.shtm
Reference
V tomto článku byl použit překlad textu z článku Hydroboration–oxidation reaction na anglické Wikipedii.
- Marc G. Loudon. Organic Chemistry. New York: Oxford University Press, 2002. Dostupné online. ISBN 0-19-511999-1. Kapitola Addition Reactions of Alkenes, s. 168–172.
- H. C. Brown; G. Zweifel. A STEREOSPECIFIC CIS HYDRATION OF THE DOUBLE BOND IN CYCLIC DERIVATIVES. Journal of the American Chemical Society. 1959, s. 247. DOI 10.1021/ja01510a059.
- H. C. Brown; B. C. Rao. Communications – Selective Conversion of Olefins into Organoboranes Through Competitive Hydroboration, Isomerization and Displacement Reactions. Journal of Organic Chemistry. 1957, s. 1137. DOI 10.1021/jo01360a626.
- M. F. Rao. Amine Boranes. VIII. The Hydroboration of Terminal Olefins, Dienes and Terminal Acetylenes with Trimethylamine t-Butylborane. Journal of the American Chemical Society. 1961, s. 2541–2544. DOI 10.1021/ja01472a027.
- H. C. Brown; S. K. Gupta. Catecholborane (1,3,2-benzodioxaorole) as a new, general monohydroboration reagent for alkynes. Convenient synthesis of alkeneboronic esters and acids from alkynes via hydroboration. Journal of the American Chemical Society. 1972, s. 4370. DOI 10.1021/ja00767a072.
- Matthew H. Yates. One-pot conversion of olefins to carbonyl compounds by hydroboration / NMO–TPAP oxidation. Tetrahedron Letters. 1997, s. 2813–2816. DOI 10.1016/S0040-4039(97)00476-0.
- Herbert C. Brown; Shekhar V. Kulkarni; Vijay V. Khanna; Uday S. Racherla. Organoboranes for Synthesis. 14. Convenient Procedures for the Direct Oxidation of Organoboranes from Terminal Alkenes to Carboxylic Acids. The Journal of Organic Chemistry. 1992, s. 6173–6177. DOI 10.1021/jo00049a024.